1、选择题 可逆反应?N2+H2?2NH3?是一个放热反应.有甲、乙两个完全相同的容器,向甲容器中加入1mol?N2和3mol?H2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2mol?NH3,达平衡时,吸收的热量为Q2.已知Q2=4Q1,则甲容器中,H2的转化率为( )
A.20%
B.25%
C.75%
D.80%
参考答案:由于1molN2和3molH2完全反应可以生成2molNH3,所以甲乙两个体系的平衡状态是一样的,即三种气体的浓度完全相同,对于同一可逆反应,相同条件下,正反应的反应热与逆反应的反应热,数值相等,符号相反.N2和H2完全反应时放热Q,则NH3完全分解时吸热也是Q,
假设甲容器中的参加反应的氮气的物质的量为xmol,所以:
对于甲容器:N2(g)+3H2(g)?2NH3(g)△H=-QkJ/mol
起始(mol):1? 3? ?0
变化(mol):x? 3x? 2x
平衡(mol):1-x? 3-3x?2x
所以Q1=xQkJ,
乙容器反应混合物各组分的物质的量也是为N2(1-x?)mol、H2(3-3x?)mol、NH32xmol,所以分解的NH3的物质的量为(2-2x)mol,
对于乙容器:2NH3(g)?N2(g)+3H2(g)△H=+QkJ/mol,故吸收的热量Q2=2-2x2QkJ=(1-x)QkJ,
所以(1-x)Q=4xQ,解得x=0.2,所以H2的转化率为0.2mol×33mol=20%,
故选A.
本题解析:
本题难度:一般
2、选择题 反应4A(s)+3B(g)? = 2C(g)+D(s),经2min,B的浓度减少0.6 mol/L。对此化学反应速率的正确表示是?
[? ]
A.用A表示的反应速率是0.4 mol/(L·min)
B.分别用B、C表示反应的速率,其比值是3:2
C.在2 min末的反应速率,用B表示是0.3 mal/(L·min)
D.在这2 min内B和C两物质浓度都逐渐减小
参考答案:B
本题解析:
本题难度:简单
3、填空题 工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
化学反应
| 平衡
常数
| 温度/℃
|
500
| 700
| 800
|
①2H2(g)+CO(g) CH3OH(g) CH3OH(g)
| K1
| 2.5
| 0.34
| 0.15
|
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g)
| K2
| 1.0
| 1.70
| 2.52
|
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g)
| K3
| ?
| ?
| ?
|
?
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
(3)500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________v逆(填“>”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是__________(填序号)。

A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
参考答案:(1)吸热 (2)K1·K2 (3)> (4)CD
本题解析:(1)由表中数据知,温度越高,平衡常数越大,所以反应②为吸热反应。
(2)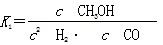
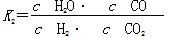
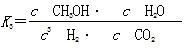
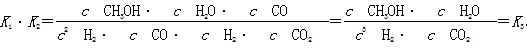
(4)根据反应①中温度与K的关系,可推断该反应为放热反应,升温,平衡左移,CO的转化率减小,所以T3>T2>T1,A错误;反应速率v(c)>v(a),v(b)>v(d),B错误;温度越高,平衡常数越小,压强对平衡常数无影响,所以K(a)>K(c),K(b)=K(d);升温,平衡左移,平均摩尔质量减小,加压,平衡右移,平均摩尔质量增大,所以M(a)>M(c),M(b)>M(d)。
本题难度:一般
4、选择题 (10分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.
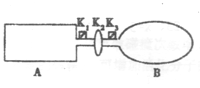
关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g) N2O4(g)△H<0。
N2O4(g)△H<0。
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A)?V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将?(填“变大”、“变小”或“不变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将?。
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将?,B中NO2的转化率将?。
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,?中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率(写出计算过程)
参考答案:(10分)(1)<?变小(2)增大?不变?变小(3)A?(4)40%
本题解析:(1)A容器相当于恒温恒容,B容器相当于恒温恒压;而2NO2(g) N2O4(g)△H<0;随反应的不断进行,A容器内压强逐渐变小,B容器内压强不变易使平衡向正反应方向移动,所以A、B中生成的N2O4的速率是V(A)<V(B);由于A容器内气体压强会不断减小,而B容器内气体压强不变,所以,当打开K3时,气球B会变小。
N2O4(g)△H<0;随反应的不断进行,A容器内压强逐渐变小,B容器内压强不变易使平衡向正反应方向移动,所以A、B中生成的N2O4的速率是V(A)<V(B);由于A容器内气体压强会不断减小,而B容器内气体压强不变,所以,当打开K3时,气球B会变小。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将增大,因加入NO2浓度增大平衡将向正反应方向移动,且由于加入NO2使容器内压强增大,从而使平衡向正反应方向移动,故当达到平衡时,NO2的转化率α(A)将增大;若通入等量的Ne气,则达到平衡时,A中NO2的转化率不变,因为从表面上看,A容器内压强增大了,但容器内各组成的浓度没度,平衡不移动,转化率即也不变;B容器为保持压强不变,体积必然会增大,导致体系内各组分的浓度降低,平衡会向逆反应方向移动,转化率将变小。
(3)B容器的现象可看成是在A容器的基础上降温,平衡将向正反应方向移动,即B容器内NO2气体的浓度将比A容器内NO2气体的浓度低,颜色将更浅。
(4)在相同条件下,体系内压强之比=物质的量之比,4.6g的NO2的物质的量为0.2mol;
2NO2(g) N2O4(g)△H<0
N2O4(g)△H<0
0.2mol? 0
2x? x
0.2mol-2x? x
得:(0.2mol-2x+x)/0.2mol
得:? x=0.04mol
所以NO2的转化率为:(2x0.04mol)/0.2mol=40%
本题难度:一般
5、选择题 下列实验事实不能用平衡移动原理解释的是( )。
A.
B.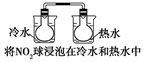
C.
D.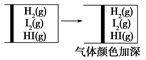
参考答案:D
本题解析:A项,水的电离是可逆过程,升高温度Kw增大,促进水的电离,正确;B项,存在平衡2NO2 N2O4,升高温度平衡向生成NO2方向移动,正确;C项,氨水中存在电离平衡,浓度越稀,电离程度越大,但离子浓度降低,c(OH-)越小,pH越小,正确。D项,对可逆反应2HI(g)
N2O4,升高温度平衡向生成NO2方向移动,正确;C项,氨水中存在电离平衡,浓度越稀,电离程度越大,但离子浓度降低,c(OH-)越小,pH越小,正确。D项,对可逆反应2HI(g) H2(g)+I2(g),增大平衡体系的压强,平衡不移动,故不能用勒夏特列原理解释。但体系中各气体的浓度均增大,颜色变深。
H2(g)+I2(g),增大平衡体系的压强,平衡不移动,故不能用勒夏特列原理解释。但体系中各气体的浓度均增大,颜色变深。
本题难度:一般