1、选择题 把0.05 mol NaOH固体分别加入到下列100 mL溶液中,导电能力变化较大的是 ( )
A.0.5 mol/L MgSO4溶液
B.0.5 mol/L盐酸
C.0.5 mol/L的CH3COOH溶液
D.0.5 mol/L NH4Cl溶液
2、选择题 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。有关说法正确的是

A.a、b、c三点溶液的pH:a>b>c
B.若使C点的醋酸根离子浓度增大,溶液的pH也增大,可加入适量的醋酸钠固体
C.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D.用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
3、选择题 已知25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)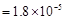 ,Ka(HSCN)
,Ka(HSCN)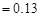 。在物质的量浓度均为
。在物质的量浓度均为 mol·L
mol·L 的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
A.c(OH )>c(CH3COOH)>c(HSCN)>c(H
)>c(CH3COOH)>c(HSCN)>c(H )
)
B.c(OH )>c(HSCN)>c(CH3COOH)>c(H
)>c(HSCN)>c(CH3COOH)>c(H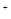 )
)
C.c(OH )>c(SCN
)>c(SCN )>c(CH3COO
)>c(CH3COO )>c(H
)>c(H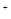 )
)
D.c(OH )>c(CH3COO
)>c(CH3COO )>c(SCN
)>c(SCN )>c(H
)>c(H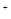 )
)
4、选择题 pH=2的两种一元酸X和Y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加0.1 mol/L NaOH至pH=7,消耗NaOH溶液的体积为Vx、Vy,下列说法正确的是

A.X为弱酸,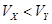
B.Y为强酸,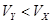
C.X为强酸,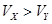
D.Y为弱酸,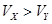
5、选择题 已知HA、H2B为二种弱酸,HA的电离常数为KHA,H2B的电离 常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不
常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不
能进行的是?(?)
A.NaA+H2B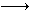 NaHB+HA? B.2NaA+H2B
NaHB+HA? B.2NaA+H2B Na2B+2HA
Na2B+2HA
C.NaHB+HA NaA+H2B? D.Na2B+HA
NaA+H2B? D.Na2B+HA NaHB+NaA
NaHB+NaA