1、实验题 某学生用已知物质的量浓度的盐酸测定未知物质的/量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1用标准的盐酸滴定待测的NaOH溶液时:左手_______________________,右手_____________________眼睛注视__________________________________直到因加入一滴盐酸后,溶液由黄色变______色,并且_____________________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是()
A:酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B:滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C:酸式滴定管在滴定前有气泡 ,滴定后气泡消失
,滴定后气泡消失
D:读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL终点读数为_______mL,所用盐酸溶液的体积为_________mL
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数
| 待测NaOH溶液的体积[来源:91考试网]
| 0.1000mol/L盐酸的体积/mL[来源:学+科+网]
|
滴定前刻度
| 滴定后刻度
| 溶液体积/mL
|
第一次
| 25.00
| 0.00
| 26.11
| 26.11
|
第二次
| 25.00
| 1.56
| 30.30
| 28.74
|
第三次
| 25.00
| 0.22
| 26.31
| 26.09
|
依据上表数据列式计算该NaOH溶液的物质的量浓度:____________________________
参考答案:(1)控制活塞, 拿锥形瓶按顺时针方向摇动 ,眼睛注视锥形瓶中指示剂颜色的变化 ,橙 ,半分钟不变色
(2) D (3) 0.00 , 26.10 , 26.10(4)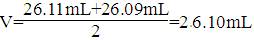 ,
,
C( NaOH)=0.1000mol·L-1×26.10mL/225.00mL=0.1044mol/L
NaOH)=0.1000mol·L-1×26.10mL/225.00mL=0.1044mol/L
本题解析:略
本题难度:一般
2、填空题 (14分)滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定 用标准盐酸滴定未知浓度的NaOH溶液。
①酸式滴定管、碱式滴定管、温度计、量筒、玻璃棒、烧杯。若要进行中和滴定实验,还缺少的玻璃仪器是 。
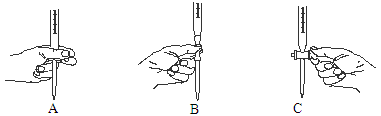
②上述滴定过程中操作滴定管的图示,正确的是 。
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得NaOH 溶液浓度 (填“偏大”、“偏小”或“无影响”)。
(2)氧化还原滴定 用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。
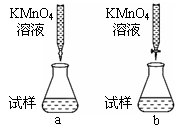
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得识,你认为合理的是 (填字母序号)。
②判断滴定终点的依据是 。
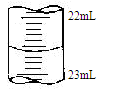
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)沉淀滴定 滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选的指示剂是 (填选项字母)。
难溶物
| AgCl
| AgBr
| AgCN
| Ag2CrO4
| AgSCN
|
颜色
| 白
| 浅黄
| 白
| 砖红
| 白
|
KSP
| 1.77×10-10
| 5.35×10-13
| 1.21×10-16
| 1.12×10-12
| 1.0×10-12
|
A、NaCl B、NaBr C、NaCN D、Na2CrO4
参考答案:(1)①锥形瓶 ② A ③无影响(2)①b [来源:Z§xx§k.Com]②溶液恰好由无色变浅紫红色,且半分钟内不 褪 色 ③22.10mL(3)D
本题解析:(1)①进行酸碱中和滴定实验时,待测液要装在锥形瓶中,所以还缺少锥形瓶。②在进行滴定操作是时,要用左手控制酸式滴定管的活塞,所以A对,C错,挤压碱式滴定管的玻璃球时要往外挤压,B错。③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,对NaOH物质的量没有影响,所以再继续滴定至终点,盐酸的用量不变,故对所测得NaOH 溶液浓度没有影响。(2)①酸性高锰酸钾有强氧化性,要用酸式滴定管装,所以b对。②草酸溶液是无色的,高锰酸钾溶液是紫色的,所以滴定终点的现象为:当滴最后一滴高锰酸钾溶液时,溶液恰好由无色变浅紫红色,且半分钟内不褪色。③滴定后滴定管的读数为22.60mL,此时消耗标准溶液的体积为22.60mL-0.5 mL=22.10mL。(3)用AgNO3滴定NaSCN溶液生成的AgSCN是白色沉淀,为了现象明显,指示剂不能再是白色的,排除AgCl 和AgCN,在根据沉淀滴定的原理:滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。选D。
考点:酸碱中和滴定、氧化还原滴定和沉淀滴定的误差分析、指示剂的选择、滴定终点的判定等。
本题难度:困难
3、填空题 (1)下列操作使结果偏高(或增大)的是 .
①用稀NaOH溶液与稀盐酸反应测定反应热,用铁质搅拌器
②中和滴定的锥形瓶用蒸馏水洗后,未用待测液洗
③用0.1mol·L-1的NaOH溶液滴定未知浓度的盐酸,碱式滴定管未用标准液润洗
④用蒸馏水湿润的pH试纸测定0.1mol·L-1的醋酸溶液的pH
(2)在纯碱溶液中滴入酚酞,溶液变红。原因是 (用离子方程式表示)若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是 ,其原因是(以离子方程式和简要文字说明): 。
参考答案:(1)③④ (2分) (2)CO32-+H2O  HCO3-+OH-(2分)
HCO3-+OH-(2分)
产生白色沉淀,且红色褪去;(2分)
在纯碱中加入BaCl2溶液后,Ba2++CO32-=BaCO3¯(白色),c( CO32-)减小,CO32-水解平衡向左移动,c(OH-)减小,酚酞褪色。(2分)
本题解析:(1)③滴定管未用标准液润洗,会使浓度稀释,所用的溶液也就多,故会偏大;④PH试纸湿润了,会稀释醋酸溶液,酸性减弱,PH会增大。(2) 纯碱溶液中纯碱是强碱弱酸盐,水解成碱性,遇酚酞显红色,离子方程式为CO32-+H2O  HCO3-+OH-。加入氯化钡溶液,Ba2+会和CO32-反应,使水解反应逆向移动,碱性就减弱,颜色就退去。
HCO3-+OH-。加入氯化钡溶液,Ba2+会和CO32-反应,使水解反应逆向移动,碱性就减弱,颜色就退去。
考点:配制一定物质的量浓度的溶液 中和滴定 PH试纸 盐类的水解
点评:本题主要考查了一些实验操作和盐类水解的知识,掌握实验的原理及正确的操作和盐类水解的原理是解题的关键。
本题难度:一般
4、选择题 下列关于中和滴定的操作错误的是
A.滴定前需要检查滴定管是否漏水
B.用对应加入的溶液润洗的仪器有:酸式滴定管、锥形瓶
C.用标准盐酸测定氨水的浓度,最适宜使用的指示剂是甲基橙
D.已知浓度滴定未知溶液,终点读数时俯视滴定管的刻度,会造成计算值偏低