| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《水的电离平衡》高频考点巩固(2019年模拟版)(八)
参考答案:A 本题解析:H2SO4溶液抑制水的电离,分析其中水的电离计算其中氢氧根;Ba(OH)2溶液抑制水的电离,分析其中水的电离计算其中氢离子;Na2S溶液、NH4NO3溶液促进水的电离,根据PH可直接求出发生电离的水的物质的量。设溶液的体积为1L,①pH=0的H2SO4中c(H+)=1.0 mol?L-1,c(OH-)=1.0×10-14mol?L-1,水电离的物质的量为1.0×10-14mol;②0.05 mol·L-1的Ba(OH)2溶液中c(OH-)=0.1 mol?L-1,c(H+)=1.0×10-13mol?L-1,水电离的物质的量为1.0×10-13mol;③pH = 10的Na2S溶液中c(OH-)=1.0×10-4mol?L-1,水的电离的物质的量为1.0×10-4mol;④pH=5的NH4NO3溶液中c(H+)=1.0×10-5mol?L-1,水的电离的物质的量为1.0×10-5mol;①②③④中水的电离的物质的量之比为:1.0×10-14mol:1.0×10-13mol:1.0×10-4mol1:1.0×10-5mol=1:10:1010:109,选A。 本题难度:一般 4、选择题 从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测( ) |
参考答案:A
本题解析:色素,实际上是一种有机弱酸,用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪去,由题意可知,在盐酸和硝酸中均显示红色,在硝酸中加热后褪色,是硝酸的强氧化性使之褪色,所以可推测HR应为红色。故选A。
考点:指示剂变色
点评:盐酸只有酸性年,而浓硝酸具有酸性和强氧化性,在本题中硝酸主要表现为强氧化性,能使指示剂褪色。
本题难度:一般
5、填空题 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH 11(填“>”“=”或“<”),原因是 (用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为 ;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈 性,溶液中c(Na+)
c(CH3COO-)(填“>”“=”或“<”);
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图。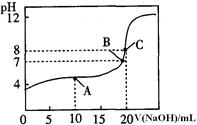
①为减小实验误差,由图可知滴定时指示剂应选用 (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是 &# 160; 点对应的溶液;
③25OC,HA的电离平衡常数约为 。
参考答案:(1) > 加水稀释使平衡CH3COO-+H2O CH3COOH+OH-右移 >
CH3COOH+OH-右移 >
(2)①=②>③
(3)碱 > 酸 <
(4)①酚酞 ②C ③5×10ˉ4
本题解析:
(1)首先写出CH3COO-+H2O CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1 mol·L-1÷100=10-3 mol·L-1,但平衡右移c(OH-)应比10-3 mol·L-1大,所以最终溶液中c(OH-)>10-3 mol·L-1;加热促进了CH3COO-的水解,使c(OH-)增大。
CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1 mol·L-1÷100=10-3 mol·L-1,但平衡右移c(OH-)应比10-3 mol·L-1大,所以最终溶液中c(OH-)>10-3 mol·L-1;加热促进了CH3COO-的水解,使c(OH-)增大。
(2)依据NH4++H2O NH3·H2O+H+,因为①、②中的H+全部是水解生成的,且c(H+)相同,所以c(NH4+)①=②;由NH4HSO4=NH4++H++SO42-可知③中的H+大部分是电离生成的,所以c(NH4HSO4)远远小于c(NH4Cl)。
NH3·H2O+H+,因为①、②中的H+全部是水解生成的,且c(H+)相同,所以c(NH4+)①=②;由NH4HSO4=NH4++H++SO42-可知③中的H+大部分是电离生成的,所以c(NH4HSO4)远远小于c(NH4Cl)。
(3)正好完全中和生成CH3COONa,CH3COO-水解,显碱性;混合后溶液中含有CH3COONa、CH3COOH,显酸性,溶液中存在CH3COONa=CH3COO-+Na+、CH3COO-+H2O CH3COOH+OH-、CH3COOH
CH3COOH+OH-、CH3COOH CH3COO-+H+、H2O
CH3COO-+H+、H2O OH-+H+,CH3COOH的电离程度大于CH3COO-的水解程度,所以电离生成的CH3COO-大于水解消耗的CH3COO-,即c(Na+)<c(CH3COO-);我们也可以用电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)求解,因为混合后溶液呈酸性,所以c(H+)>c(OH-),所以c(Na+)<c(CH3COO-)。
OH-+H+,CH3COOH的电离程度大于CH3COO-的水解程度,所以电离生成的CH3COO-大于水解消耗的CH3COO-,即c(Na+)<c(CH3COO-);我们也可以用电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)求解,因为混合后溶液呈酸性,所以c(H+)>c(OH-),所以c(Na+)<c(CH3COO-)。
(4)①石蕊变色范围PH5.8——8.0 由红色变为蓝色,甲基橙变色范围 PH3.1——4.4 由红色变为黄色,酚酞变色范围 PH8.2——10.0 由无色变为红色,故选酚酞。
②C为强碱性溶液,离子浓度最大。
③C点,PH=8.则c(OH-)=10ˉ6 mol/L对于CH3COO-+H2O CH3COOH+OH-,c(OH-)=10ˉ6 mol/L,则c(CH3COOH)=10ˉ6 mol/L。c(CH3COO-)=20.00mL*0.1000mol/L/40mL=0.05mol/L。CH3COO-水解程度较小,可以忽略。所以该平衡的平衡常数为K1= c(OH-)* c(CH3COOH)/ c(CH3COO-)=2*10ˉ11。
CH3COOH+OH-,c(OH-)=10ˉ6 mol/L,则c(CH3COOH)=10ˉ6 mol/L。c(CH3COO-)=20.00mL*0.1000mol/L/40mL=0.05mol/L。CH3COO-水解程度较小,可以忽略。所以该平衡的平衡常数为K1= c(OH-)* c(CH3COOH)/ c(CH3COO-)=2*10ˉ11。
CH3COO-+H2O CH3COOH+OH- K1=2*10ˉ11
CH3COOH+OH- K1=2*10ˉ11
H2O H++OH- Kw=10ˉ14
H++OH- Kw=10ˉ14
CH3COOH CH3COO-+H+ K=?
CH3COO-+H+ K=?
解得:K=5×10ˉ4
考点:电解质溶液PH的计算,酸碱中和滴定
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《燃烧热》高.. | |