|
|
|
高中化学必备知识点《水的电离平衡》高频考点巩固(2019年模拟版)(五)
2019-06-28 22:56:44
【 大 中 小】
|
1、选择题 常温时,向pH=12的Ba(OH)2溶液中加入等体积的下列溶液后,滴入酚酞试液出现红色,该溶液应该是
A.pH=2的硫酸溶液
B.pH=2的醋酸溶液
C.0.05mol/L盐酸溶液
D.0.05mol/LNa2SO4溶液
|
2、填空题 写出下列物质在水溶液中的电离方程式
氯化铜______
硫酸铁______
碳酸氢钠______
硫酸氢钠______.
3、选择题 21.化学中通常用图像直观地描述化学反应进程或结果。下列图像及描述正确的是
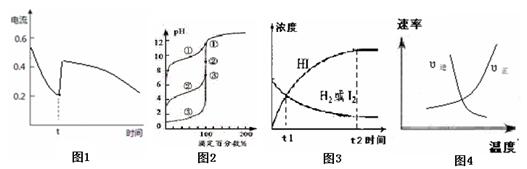
A.图1表示Zn-Cu原电池反应过程中的电流强度的变化,t时可能加入了双氧水
B.图2表示用0.1000mol·L-1NaOH溶液滴定浓度相同的三种一元酸,曲线①的酸性最强
C.图3表示可逆反应:H2(g)+I2(g)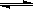 2HI(g)在一段时间内,各组分浓度的变化图,t1时刻速率关系为:υ正=υ逆 2HI(g)在一段时间内,各组分浓度的变化图,t1时刻速率关系为:υ正=υ逆
D.图4表示可逆反应:N2(g)+O2(g)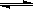 2NO(g)ΔH <0 ,正、逆反应速率随温度变化的曲线图 2NO(g)ΔH <0 ,正、逆反应速率随温度变化的曲线图
|
4、选择题 室温下,把1mL 0.05mol/L的H2SO4加水稀释成1L溶液,在此溶液中由水电离产生的H+,其浓度接近于
A.1×10-4 mol/L
B.1×10-8 mol/L
C.1×10-11 mol/L
D.1×10-10 mol/L
5、实验题 某学生用已知物质的量浓度的盐酸测定未知物质的/量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1用标准的盐酸滴定待测的NaOH溶液时:左手_______________________,右手_____________________眼睛注视__________________________________直到因加入一滴盐酸后,溶液由黄色变______色,并且_____________________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是()
A:酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B:滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C:酸式滴定管在滴定前有气泡 ,滴定后气泡消失
,滴定后气泡消失
D:读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL终点读数为_______mL,所用盐酸溶液的体积为_________mL
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数
| 待测NaOH溶液的体积[来源:91考试网]
| 0.1000mol/L盐酸的体积/mL[来源:学+科+网]
|
滴定前刻度
| 滴定后刻度
| 溶液体积/mL
|
第一次
| 25.00
| 0.00
| 26.11
| 26.11
|
第二次
| 25.00
| 1.56
| 30.30
| 28.74
|
第三次
| 25.00
| 0.22
| 26.31
| 26.09
|
依据上表数据列式计算该NaOH溶液的物质的量浓度:____________________________
 ,滴定后气泡消失
,滴定后气泡消失