1、选择题 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g)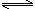 N2(g)+3H2(g)?△H=+92.4kJ/mol
N2(g)+3H2(g)?△H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
容器编号
| 起始时各物质物质的量/mol
| 平衡时反应中的能量变化
|
NH3
| N2
| H2
|
①
| 2
| 0
| 0
| 吸收热量akJ
|
②
| 0
| 1
| 3
| 放出热量bkJ
|
③
| 4
| 0
| 0
| 吸收热量ckJ
|
?
下列叙述正确的是
A.热量关系:a=b
B.反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
参考答案:C
本题解析:A、反应①②平衡状态相同,但加入物质不同,热量关系为:a+b=92.4,错误;B、3个反应温度相同,所以平衡常数相等,错误;C、反应③加入的反应物是反应①的2倍,在等温等容的条件下,容器③的压强大,平衡向左移动,所以达平衡时H2的体积分数:①>③,正确;D、根据质量守恒定律,气体的质量不变,容器恒容,所以密度是一个定值,密度不变不能说明反应已达到平衡,错误。
本题难度:一般
2、选择题 合成氨所需的氢气可由水煤气反应制得,其中的一步反应为: CO(g)+H2O(g)  CO2(g) +H2(g);△H=-43kJ·mol-1对于此反应,下列措施中能提高CO转化率的是
CO2(g) +H2(g);△H=-43kJ·mol-1对于此反应,下列措施中能提高CO转化率的是
A.增大压强
B.升高温度
C.增大CO的浓度
D.增大水蒸气的浓度
参考答案:D
本题解析:考查外界条件对化学平衡的影响。根据方程式可知,反应前后体积不变,因此压强也是不变的,则改变压强平衡不移动,转化率不变;正反应是放热反应,升高温度平衡向逆反应方向进行,转化率降低;增大CO浓度,平衡向正反应方向进行,但CO转化率是降低的;增大水蒸气浓度,平衡向正反应方向进行,CO转化率是增大的,所以正确的答案选D。
本题难度:一般
3、填空题 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)已知:H-H键能为436kJ?mol-1,N≡N键能为946kJ?mol-1,N-H键能为391kJ?mol-1.写出合成氨反应的热化学方程式:______
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30
c(NH3)/mol?L-1
0.08
0.14
0.18
0.20
0.20
0.20
|
①5min内,消耗H2的平均反应速率为______
②N2的平衡转化率______
③此条件下该反应的化学平衡常数K=______.反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向______方向移动(填“正反应”或“逆反应”);化学平衡常数值______(填变大、变小、不变);
④若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度______0.4mol?L-1(填大于、小于与等于)
参考答案:(1)反应N2(g)+3H2(g)?2NH3(g)的反应热△H=946kJ?mol-1+3×436kJ?mol-1-2×3×391kJ?mol-1=-92kJ?mol-1,故热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1;
(2)①由表中水解可知,5min内,氨气的浓度变化为0.08mol/L,故v(NH3)=0.08mol/L5min=0.016mol/(L?min),速率之比等于化学计量数之比,故v(H2)=32v(NH3)=32×0.016mol/(L?min)=0.024mol/(L?min),故答案为:0.024mol/(L?min);
②由表中数据可知,20min达平衡,平衡时NH3的浓度为0.20mol/L,生成的氨气的物质的量为0.20mol/L×4L=0.8mol,由方程式N2(g)+3H2(g)?2NH3(g)可知,参加反应的氮气的物质的量为12×0.8mol=0.4mol,所以氮气的转化率为:0.4mol2mol×100%=20%,故答案为:20%;
③由表中数据可知,20min达平衡,平衡时NH3的浓度为0.20mol/L,则:
?N2(g)+3H2(g)?2NH3(g)
开始(mol/L):0.5? 1.3? 0
变化(mol/L):0.1? 0.3? 0.2
平衡(mol/L):0.4? 1? 0.2
故平衡常数k=c2(NH3)c(N2)?c3(H2)=0.220.4×13=1,
反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,则此时各物质的浓度为:
H2为1mol/L+8mol4L=3mol/L,N2为0.4mol/L+8mol4L=2.4mol/L,NH3为0.2mol/L+8mol4L=2.2mol/L,故浓度商Qc=2.222.4×33<1,故反应向正反应进行,
平衡常数只受温度影响,温度不变平衡常数不变,
故答案为:1;正反应;不变;
④只将容器体积由4L变为2L,若平衡不移动氮气的浓度为原来2倍为0.8mol/L,但体积减小压强增大,平衡向正反应移动,故氮气的平衡浓度小于原平衡浓度的2倍,大于原平衡的浓度,即0.4mol/L<c(N2)<0.8mol/L,故答案为:大于.
本题解析:
本题难度:简单
4、选择题 在恒容密闭容器中,可逆反应H2(g)+I2(g)  ?2HI(g) 达到平衡状态时的标志是
?2HI(g) 达到平衡状态时的标志是
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色的深浅和浓度有关系,所以选项B可以说明。反应前后气体的体积不变,因此气体的总物质的量、体积和压强始终是不变的,A不能说明。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,CD不能说明,因此答案选A。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:一般
5、填空题 已知:2SO2(g)+O2(g) 2SO3(g)?ΔH=-196.0kJ·mol-1
2SO3(g)?ΔH=-196.0kJ·mol-1
2NO(g)+O2(g) 2NO2(g)?ΔH="-113.0" kJ·mol-1
2NO2(g)?ΔH="-113.0" kJ·mol-1
2SO3(l) 2SO3(g)?ΔH=" 20.0" kJ·mol-1
2SO3(g)?ΔH=" 20.0" kJ·mol-1
则NO2与SO2反应生成SO3(l)和一种无色气体的热化学方程式?;?
若在一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是?。
a.体系压强保持不变?
b.混合气体颜色保持不变?
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
②该反应达平衡时,测得NO2的转化率为50%,则反应前后容器内压强比为?。
③恒压密闭容器中发生上述反应时,若加入Ar气,使得反应速率?(变大、变小或不变)。
参考答案:SO2(g)+NO2(g) SO3(l)+NO(g)?△H=-51.5 kJ·mol-1
SO3(l)+NO(g)?△H=-51.5 kJ·mol-1
①a,b?② 6:5?③变小
本题解析:考查盖斯定律的应用。由反应①2SO2(g)+O2(g) 2SO3(g)? ΔH=-196.0kJ·mol-1、反应②2NO(g)+O2(g)
2SO3(g)? ΔH=-196.0kJ·mol-1、反应②2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1和③2SO3(l)
2NO2(g) ΔH="-113.0" kJ·mol-1和③2SO3(l) 2SO3(g)? ΔH=" 20.0" kJ·mol-1可知,即①-②-③得2SO2(g)+2NO2(g)
2SO3(g)? ΔH=" 20.0" kJ·mol-1可知,即①-②-③得2SO2(g)+2NO2(g) 2SO3(l)+2NO(g),所以其△H=-103 kJ·mol-1。
2SO3(l)+2NO(g),所以其△H=-103 kJ·mol-1。
①因为反应前后体积是变化的,所以当压强不再变化时,可以说明已经达到平衡。颜色的深浅与其浓度大小有关,所以当颜色不再变化时,也可以说明已经达到平衡状态。三氧化硫是液体,C不正确。消耗消耗1 mol SO3的同时必然生成1 molNO2 m,不能说明。
②? SO2(g)+NO2(g) SO3(l)+NO(g)
SO3(l)+NO(g)
起始量(mol)?2? 1? 0? 0
转化量(mol)? 0.5? 0.5? 0.5? 0.5
平衡量(mol)? 1.5? 0.5? 0.5? 0.5
反应前后容器内压强比为 .
.
③恒压密闭容器中发生上述反应时,若加入Ar气,则容器的体积必然增大,即物质的浓度会减小,反应速率则降低。
本题难度:一般