|
|
|
高中化学必备知识点《反应速率与平衡的有关计算》练习题(七)
2019-07-03 23:17:35
【 大 中 小】
|
1、简答题 (14分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g)?△H 1 = +489.0 kJ·mol-1
?②C(石墨) +CO2(g) = 2CO(g)?△H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为?。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g)?△H CH3OH(g) +H2O(g)?△H
①该反应的平衡常数表达式为K=???。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH?0 (填“>”、“<”或“=”)。

③在两种不同条件下发生反应,测得CH3OH的物质 的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ?KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为?。
当氨碳比 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为:?。 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为:?。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为?。
2、填空题 一定条件下,在一定体积的恒容密闭容器中,CO2与NH3在一定条件下反应生成尿素
CO2(g)+2NH3(g)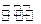 CO(NH2)2(s)+H2O(g) CO(NH2)2(s)+H2O(g)
根据题意完成下列各题;

(1)500℃,用尿素表示该反应的反应速率,v(尿素)=?mol/min.
(2)该反应的正反应△H?0(填“>”或“<”)。
(3)上图2表示某温度时一些反应物与产物物质的量(n)随时间(t)变化的关系。
①对于该反应达到平衡状态的判断,下列说法正确的是?。
A.混合气体的密度不再发生改变
B.图2中C点时,该反应达到了平衡状态
C.混合气体的压强不再发生改变
D.当消耗了2n mol NH3时,同时生成了n molH2O
| ②反应速率v(CO2):图中点a?b(填“>”、“<”或“=”)。
(4)用该原理生产尿素,工业上一般在220大气压下进行。其它条件不变,与常压相比,220大气压时NH3的转化率?(填增大、减小或不变。)反应的平衡常数K?(填增大、减小或不变)。
3、选择题 一定温度下,在体积为 VL 的密闭容器中加入1molX和1molY进行如下反应:
X(g) + Y(g ) 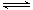 2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是(?) 2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是(?)
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后加入X,上述反应的△H增大
C.温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的1/2
D.当容器中混合气体的压强不变时,可以证明此反应已达到平衡状态
4、填空题 (10分)工业上用CO生产燃料甲醇。一定条件下发生反应: 。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。 。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
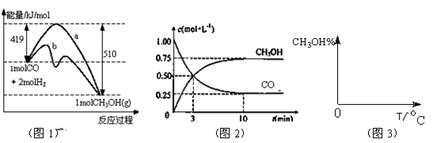
请回答下列问题:
(1)在“图1”中,曲线??(填a或b)表示使用了催化剂;该反应属于??(填吸热、放热)反应。
(2)下列说法正确的是???
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小
|
(3)从反应开始到建立平衡,
v(H2)=
???;该温度下CO(g)+2H2(g)

CH3OH(g)的化学平衡常数为
???。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数
???(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ;ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g)?ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式
???。
5、选择题 对于可逆H2(g)+I2(g) 2HI(g),下列情况一定能说明反应已达到平衡状态的是(?)
2HI(g),下列情况一定能说明反应已达到平衡状态的是(?)
A.气体总压强不再随时间而改变时
B.气体的总质量不再改变时
C.混合气体中各组成成分的含量不再改变时
D.单位时间内每消耗1 mol I2,同时有2 mol HI生成时
 CH3OH(g)的化学平衡常数为???。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数???(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为???。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数???(填“增大”、“减小”或“不变”)。 2HI(g),下列情况一定能说明反应已达到平衡状态的是(?)
2HI(g),下列情况一定能说明反应已达到平衡状态的是(?)