1、选择题 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g)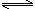 N2(g)+3H2(g)?△H=+92.4kJ/mol
N2(g)+3H2(g)?△H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
容器编号
| 起始时各物质物质的量/mol
| 平衡时反应中的能量变化
|
NH3
| N2
| H2
|
①
| 2
| 0
| 0
| 吸收热量akJ
|
②
| 0
| 1
| 3
| 放出热量bkJ
|
③
| 4
| 0
| 0
| 吸收热量ckJ
|
?
下列叙述正确的是
A.热量关系:a=b
B.反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
2、选择题 合成氨所需的氢气可由水煤气反应制得,其中的一步反应为: CO(g)+H2O(g)  CO2(g) +H2(g);△H=-43kJ·mol-1对于此反应,下列措施中能提高CO转化率的是
CO2(g) +H2(g);△H=-43kJ·mol-1对于此反应,下列措施中能提高CO转化率的是
A.增大压强
B.升高温度
C.增大CO的浓度
D.增大水蒸气的浓度
3、填空题 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)已知:H-H键能为436kJ?mol-1,N≡N键能为946kJ?mol-1,N-H键能为391kJ?mol-1.写出合成氨反应的热化学方程式:______
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30
c(NH3)/mol?L-1
0.08
0.14
0.18
0.20
0.20
0.20
|
①5min内,消耗H2的平均反应速率为______
②N2的平衡转化率______
③此条件下该反应的化学平衡常数K=______.反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向______方向移动(填“正反应”或“逆反应”);化学平衡常数值______(填变大、变小、不变);
④若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度______0.4mol?L-1(填大于、小于与等于)
4、选择题 在恒容密闭容器中,可逆反应H2(g)+I2(g)  ?2HI(g) 达到平衡状态时的标志是
?2HI(g) 达到平衡状态时的标志是
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
5、填空题 已知:2SO2(g)+O2(g) 2SO3(g)?ΔH=-196.0kJ·mol-1
2SO3(g)?ΔH=-196.0kJ·mol-1
2NO(g)+O2(g) 2NO2(g)?ΔH="-113.0" kJ·mol-1
2NO2(g)?ΔH="-113.0" kJ·mol-1
2SO3(l) 2SO3(g)?ΔH=" 20.0" kJ·mol-1
2SO3(g)?ΔH=" 20.0" kJ·mol-1
则NO2与SO2反应生成SO3(l)和一种无色气体的热化学方程式?;?
若在一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是?。
a.体系压强保持不变?
b.混合气体颜色保持不变?
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
②该反应达平衡时,测得NO2的转化率为50%,则反应前后容器内压强比为?。
③恒压密闭容器中发生上述反应时,若加入Ar气,使得反应速率?(变大、变小或不变)。