1、选择题 可逆反应aA(g)+bB(s) cC(g)+dD(g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是(?)
cC(g)+dD(g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是(?)
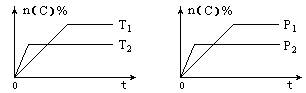
A.温度降低,化学平衡向逆反应方向移动
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.无法根据图像确定改变温度后化学平衡移动方向
参考答案:C
本题解析:(中难)本题考查勒沙特列原理的应用,根据左图所示,T2时达到平衡所需时间短,说明温度T2比T1高,因此降低温度平衡正向移动。加入催化剂,不会移动平衡。根据右图所示,P2时达到平衡所需时间短,说明压强P2比P1大,再分析纵坐标,可以看出压强越大C的物质的量分数越小,即增大压强平衡向n(c) %减小的逆向移动,即a<c+d。
本题难度:一般
2、选择题 对于密闭容器中的可逆反应:4L(g)  ?2M(g)+N(g)?△H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指
?2M(g)+N(g)?△H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指
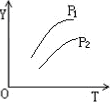
A.气体混合物的平均相对分子质量
B.气体混合物的总物质的量浓度
C.L在气体混合物的体积分数
D.气体混合物的密度
参考答案:A
本题解析:根据反应的方程式可知,该反应是体积减小的吸热的可逆反应,因此升高温度或增大压强平衡向正反应方向移动。根据图像可知随着温度升高和压强的增大,Y逐渐增大。A、混合气的平均相对分子质量等于混合气的质量与混合气总物质的量的比值,升高温度或增大压强平衡向正反应方向移动,在反应过程中混合气质量不变,但混合气的物质的量减小,因此气体混合物的平均相对分子质量逐渐增大,A正确;B、升高温度或增大压强平衡向正反应方向移动,在反应过程中混合气的物质的量减小,因此气体混合物的总物质的量浓度逐渐减小,B不正确;C、升高温度或增大压强平衡向正反应方向移动,所以L在气体混合物的体积分数减小,C不正确;D、升高温度或增大压强平衡向正反应方向移动,在反应过程中混合气质量和容器容积均不变,因此气体混合物的密度始终不变,D不正确,答案选A。
本题难度:一般
3、选择题 在一恒容的容器中充入2mol A和1mol B,发生反应2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6mol,B为0.3mol,C为1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x的值为
xC(g),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6mol,B为0.3mol,C为1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x的值为
[? ]
A.只能为2
B.只能为3
C.可能是2,也可能是3
D.无法确定
参考答案:C
本题解析:
本题难度:一般
4、选择题 在一定温度下发生反应:I2(g)+H2(g) 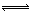 2HI(g);?△H<0并达平衡。HI的体积分数
2HI(g);?△H<0并达平衡。HI的体积分数 随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下
随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下 的变化如曲线(I)所示。在乙条件下
的变化如曲线(I)所示。在乙条件下 的变化如曲线(III)所示。则甲条件、乙条件分别是
的变化如曲线(III)所示。则甲条件、乙条件分别是
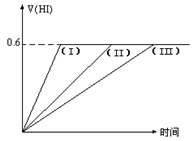
①恒容条件下,升高温度?②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积?④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当的催化剂
A.①⑤,③
B.②⑤,④
C.③⑤,②
D.③⑤,④
参考答案:D
本题解析:根据图像可知I、Ⅱ、Ⅲ到达平衡的时间依次增大,但HI的含量不变,即平衡不移动。因为反应前后体积不变,所以改变压强,平衡不移动。催化剂只能改变速率,而不改变平衡。任何化学反应都会伴随能量的变化,所以改变温度平衡一定发生移动。答案选D。
本题难度:一般
5、选择题 一定温度下,可逆反应A(s)+2B(g)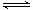 2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。
2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。
下列说法正确的是
A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
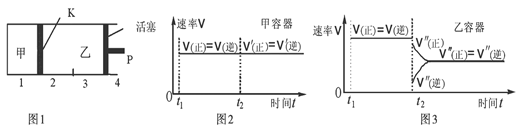
B.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持活塞位置不变,改变温度,达到新的平衡后,甲、乙中B的体积分数均增大
参考答案:B
本题解析:A错,t1时两容器内均达到平衡状态时两容器内各组分的浓度完全相同,当在甲中再加入1 mol A和2 mol B后,相当于在将乙的容器压缩为原来的一半,则平衡将向逆反应方向移动,达到新的平衡后,甲中C的浓度小于乙中C的浓度的2倍;B正确;C错,保持温度不变,移动活塞P,使乙的容积和甲相等,在这个瞬间,乙中C的体积分数是甲中C的体积分数的2倍,随后平衡将向逆反应方向移动,达到新的平衡时,乙中C的体积分数小于甲中C的体积分数的2倍;D错,改变温度不清楚是升高温度还是降低温度;无法判断;
本题难度:一般