1、选择题 对于平衡体系mA(g)+nB(g)?pC(g)+qD(g)△H<0.下列结论中错误的是( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的
要小
参考答案:A、将容器的体积缩小到原来的一半,不考虑平衡移动,此时A的浓度变为原来的2倍,现在A的浓度为原来的2.1倍,说明平衡向着生成A的方向移动了,体积缩小即增大压强,平衡向着气体体积减小的方向进行,所以m+n<p+q,故A正确;
B、反应开始时,A、B的物质的量之比为m:n,恰好等于方程式的系数值比,这种情况下平衡时,A、B的转化率相等,故B正确;
C、往含有amol气体的平衡体系中再加入amol的B,平衡向正反应移动,由于m+n=p+q,达到新平衡时混合气体总的物质的量不变,达到新平衡时气体的总物质的量等于2amol,故C正确;
D、若该反应中,m+n=p+q,温度不变时,压强增大到原来的2倍,平衡不移动,总体积变为原来的12,故D错误.
故选:D.
本题解析:
本题难度:简单
2、填空题 (12分)已知可逆反应CO + H2O (g) CO2 + H2,在830K温度下达到平衡。
CO2 + H2,在830K温度下达到平衡。
(1)其化学平衡常数K的表达式为K=?。
(2)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为______________;K值为______________。
(3)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(4)若830K时,起始浓度c (CO)=a mol/L,c (H2O)=b mol/L,H2的平衡浓度c (H2)=c mol/L,
①a、b、c之间的关系式是____________________________________;
②当a = b时,a= ________c。
参考答案:(1)K=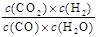 ?(2)α(H2O) =40%? K=1
?(2)α(H2O) =40%? K=1
(3)α(H2O) =25%?(4)① 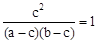 ,②a = b,则a = 2c
,②a = b,则a = 2c
本题解析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数表达式K=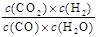 。
。
(2)? CO + H2O (g) CO2 + H2
CO2 + H2
起始浓度(mol/L)? 2? 3? 0? 0
转化浓度(mol/L)? 1.2? 1.2? 1.2? 1.2
平衡浓度(mol/L)? 0.8? 1.8? 1.2? 1.2
所以平衡时水蒸气的转化率为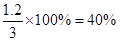
平衡常数K=
(3)? CO + H2O (g) CO2 + H2
CO2 + H2
起始浓度(mol/L)? 2? 6? 0? 0
转化浓度(mol/L)? x? x? x? x
平衡浓度(mol/L) (2-x)(6-x)? x? x
所以K=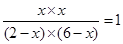
解得x=1.5mol/L
所以水蒸气的转化率是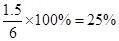
(4)①? CO + H2O (g) CO2 + H2
CO2 + H2
起始浓度(mol/L)? a? b? 0? 0
转化浓度(mol/L)? c? c? c? c
平衡浓度(mol/L) (a-c)? (b-c)? c? c
所以根据平衡常数的表达式可知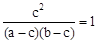
②根据①中关系式可知,当a = b时,a=2c
点评:该题是高考中的常见题型,属于中等难度的试题,试题贴近高考,注重基础和能力的双向考查,有利于培养学生分析问题、解决问题的能力。该题难易适中,学生不难得分。
本题难度:一般
3、填空题 反应N2+3H2 2NH3? ⊿H= —92.4 kJ/mol 在一定温度和体积不变的密闭容器中进行并达到平衡,如果最初c (N2 )= 2mol/L,c (H2)=5mol/L,反应达到平衡时有一半的N2发生了反应,则:
2NH3? ⊿H= —92.4 kJ/mol 在一定温度和体积不变的密闭容器中进行并达到平衡,如果最初c (N2 )= 2mol/L,c (H2)=5mol/L,反应达到平衡时有一半的N2发生了反应,则:
(1)求达到平衡时, H2和NH3的浓度分别为c (H2 )=?mol/L,c (NH3)="?" ?mol/L
(2)求平衡时H2的转化率为?;求平衡时NH3的物质的量与平衡后总物质的量的比值为?
(3)求该温度下的平衡常数为?;达到平衡后,提高温度,则平衡?(填正移,逆移或不移动);K值?;H2的转化率?(后两个空填增大,减小或不变)
参考答案:(1)c (H2 )=? 2?mol/L,c (NH3)= ?2?mol/L
(2)? 60%???0.4或2/5??
(3)? 0.5???逆移??
?减小 ??减小?
本题解析:略
本题难度:简单
4、选择题 在一定条件下,对于反应mA(g)+nB(g)  cC(g)+dD(g),C物质的浓度(c%)与温度、压强的关系如图所示,下列判断正确的是?(?)
cC(g)+dD(g),C物质的浓度(c%)与温度、压强的关系如图所示,下列判断正确的是?(?)
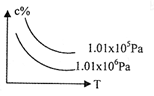
A.△H<0 △S>0
B.△H>0 △S<0
C.△H>0 △S>0
D.△H<0 △S<0
参考答案:A
本题解析:从图中可看出,升温时,C%减小,说明平衡左移,正反应为放热反应,△H<0;
在等温条件下,加压,C%减小,平衡左移,说明正反应是气体系数增大的反应,△S>0
故答案为A
本题难度:一般
5、填空题 (12分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
回答下列问题:
(1)该反应的化学平衡常数表达式为K=?。
(2)该反应为?反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是?(多选扣分)。
a.容器中压强不变? b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O)? d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为?℃。
参考答案:(1)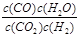 ;(2分)?(2)吸热;(2分)?
;(2分)?(2)吸热;(2分)?
(3)b、c;(2分)?(4)830 (2分)
本题解析:(1)在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度的幂之积是一个常数,这个常数就是化学平衡常数。因此该反应的化学平衡常数表达式K=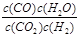 。(2)右表中数据可以看出,K随温度的升高而增大,因此温度升高平衡向正反应方向移动,故正反应是吸热反应。(3)反应前后气体的体积不变,因此在任何情况下容器中压强不变,a不能说明。根据化学平衡状态的概念可知b可以说明。依据速率之比是化学计量数之比知υ正(H2)=υ正(H2O),所以υ正(H2O)=υ逆(H2O),因此c可以说明,而d则不一定。(4)将c(CO2)·c(H2)=c(CO)·c(H2O)代入平衡常数表达式可计算出K=1,故温度是830℃。
。(2)右表中数据可以看出,K随温度的升高而增大,因此温度升高平衡向正反应方向移动,故正反应是吸热反应。(3)反应前后气体的体积不变,因此在任何情况下容器中压强不变,a不能说明。根据化学平衡状态的概念可知b可以说明。依据速率之比是化学计量数之比知υ正(H2)=υ正(H2O),所以υ正(H2O)=υ逆(H2O),因此c可以说明,而d则不一定。(4)将c(CO2)·c(H2)=c(CO)·c(H2O)代入平衡常数表达式可计算出K=1,故温度是830℃。
本题难度:一般