|
高中化学知识点归纳《盐类水解的原理》试题预测(2019年最新版)(六)
2019-07-03 23:20:20
【 大 中 小】
|
1、选择题 下面提到的问题中,与盐的水解无关的是
①明矾和FeCl3可作净水剂
②实验室保存FeCl3溶液时,要在溶液中加少量盐酸.
③在NH4Cl或AlCl3溶液中加入金属镁会产生氢气.
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂.
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞.
⑥长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用.
⑦比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性.
A.①④⑦
B.②⑤⑥
C.③⑥⑦
D.全有关.
|
参考答案:D
本题解析:略
本题难度:一般
2、填空题 (12分)(1)物质的量浓度相同的三种盐NX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是 。
(2)比较下列溶液的pH(填“>”“<”或“=”):
①0.1 mol·L-1Na2CO3溶液 0.1 mol·L-1NaHCO3溶液
②0.1 mol·L-1NH4Cl溶液 0.01 mol·L-1NH4C1溶液
(3)把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连,可以组成各种原电池。若a、b相连,a为负极;c、d相连,c极发生氧化反应;a、c相连,c为正极;b、c相连,电流由c极流向b极,则这四种金属的活动性由强到弱的顺序为 。
(4)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成份是 。
(5)氯化铁溶液呈 性(填“酸”、“碱”或“中”),原因是(用离子方程式表示):
(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,溶液的pH 7(填“>”“<”或“=”),离子反应总方程式为: 。
参考答案:(1)HX>HY>ZH;(2)① > ②> ;(3)a >b>c>d ;(4) Al2O3。(5)酸性,Fe3++3H2O Fe(OH)3+3H+;(6) < ,Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O。 Fe(OH)3+3H+;(6) < ,Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O。
本题解析:(1)物质的量浓度相同的三种盐,pH越大,说明酸根离子水解越是强烈,对应的酸越弱,所以HX、HY、HZ的酸性由强到弱的顺序为HX>HY>HZ;(2)①同浓度的Na2CO3和NaHCO3溶液,CO32-水解程度大于 HCO3-所以0.1 mol·L-1Na2CO3溶液的pH>0.1 mol·L-1NaHCO3溶液的pH,②不同浓度的NH4Cl溶液,浓度越小,NH4+水解程度越大,但是水解后溶液的酸性越弱。所以②0.1 mol·L-1NH4Cl溶液的pH<0.01 mol·L-1NH4C1溶液的pH;(3)组成各种原电池。若a、b相连,a为负极;活动性a>b,c、d相连,c极发生氧化反应为负极,活动性c>d;a、c相连,c为正极, a>c,b、c相连,电流由c极流向b极,活动性b>c,综上:a >b>c>d;(4) AlCl3溶液蒸干得到氢氧化铝,灼烧得到氧化铝。(5) 氯化铁溶液呈酸性,因为Fe3+水解,Fe3++3H2O Fe(OH)3+3H+;(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,发生的反应如下Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O.得到的是NaAlO2溶液,溶液的pH<7。 Fe(OH)3+3H+;(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,发生的反应如下Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O.得到的是NaAlO2溶液,溶液的pH<7。
考点:考查盐类的水解的应用和金属活动性比较。
本题难度:困难
3、填空题 (选做)现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<”或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
参考答案:(1)④②③①;(2)⑥⑦④⑤⑧;(3)c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);(4)>;9:2
本题解析:(1)根据水的离子积以及水电离出c(H+)=c(OH-),假设温度是常温下,①0.1mol·L-1H2SO4溶液中的OH-来自水,c(OH-)=  =5×10-14,水电离出的c(H+)=5×10-14,②醋酸是弱酸,产生的H+少,对水电离的抑制弱,③0.1mol/lNaOH溶液中,c(H+)= =5×10-14,水电离出的c(H+)=5×10-14,②醋酸是弱酸,产生的H+少,对水电离的抑制弱,③0.1mol/lNaOH溶液中,c(H+)= 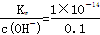 =1×10-13,④NH4Cl是弱碱强酸盐,NH4+水解使溶液显酸性,促进水的电离,因此由水电离出的H+的浓度由大到小的顺序:④②③①;(2)以④为研究对象,考虑对NH4+水解的影响,NH4++H2O =1×10-13,④NH4Cl是弱碱强酸盐,NH4+水解使溶液显酸性,促进水的电离,因此由水电离出的H+的浓度由大到小的顺序:④②③①;(2)以④为研究对象,考虑对NH4+水解的影响,NH4++H2O NH3·H2O+H+,⑤相当于向④中加入CH3COO-,CH3COO-+H2O NH3·H2O+H+,⑤相当于向④中加入CH3COO-,CH3COO-+H2O CH3COOH+OH-,互相促进水解,因此⑤中的c(NH4+)小于④中的,⑥盐类的水解是微弱的,1mol(NH4)2SO4中含有2molNH4+,因此⑥中的c(NH4+)大于④中的,是五种物质中最多的,⑦NH4HSO4=NH4++H++SO42-,电离出的H+对NH4+水解起抑制作用,c(NH4+)大于④中的,但小于⑥中的,⑧NH3·H2O是弱电解质,弱电解质的电离是微弱的,c(NH4+)是五种物质中最少的,因此c(NH4+)由大到小的顺序:⑥⑦④⑤⑧;(3)NaOH和NH4Cl等体积等浓度混合后,溶液中的溶质:NaCl、NH3·H2O且物质的量相等,NH3·H2O是弱电解质,部分电离,NaCl是强电解质全部电离,反应后的溶液显碱性,离子浓度大小顺序:c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);(4)水的离子积只受温度的影响,温度升高水的离子积增大,Kw=1×10-13>1×10-14,t℃>25℃,反应后溶液的pH=2,说明溶液呈现酸性,酸过量即: CH3COOH+OH-,互相促进水解,因此⑤中的c(NH4+)小于④中的,⑥盐类的水解是微弱的,1mol(NH4)2SO4中含有2molNH4+,因此⑥中的c(NH4+)大于④中的,是五种物质中最多的,⑦NH4HSO4=NH4++H++SO42-,电离出的H+对NH4+水解起抑制作用,c(NH4+)大于④中的,但小于⑥中的,⑧NH3·H2O是弱电解质,弱电解质的电离是微弱的,c(NH4+)是五种物质中最少的,因此c(NH4+)由大到小的顺序:⑥⑦④⑤⑧;(3)NaOH和NH4Cl等体积等浓度混合后,溶液中的溶质:NaCl、NH3·H2O且物质的量相等,NH3·H2O是弱电解质,部分电离,NaCl是强电解质全部电离,反应后的溶液显碱性,离子浓度大小顺序:c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);(4)水的离子积只受温度的影响,温度升高水的离子积增大,Kw=1×10-13>1×10-14,t℃>25℃,反应后溶液的pH=2,说明溶液呈现酸性,酸过量即: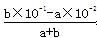 =10-2,解得:a:b=9:2。 =10-2,解得:a:b=9:2。
考点:考查水的离子积的计算、弱电解质的电离、影响盐类水解的因素、pH的计算等相关知识。
本题难度:困难
4、选择题 将NaOH溶液逐滴加入到醋酸溶液中,使溶液为中性,则此时
A.c(CH3COO-)=c(Na+)
B.c(CH3COO-)>c(Na+)
C.c(CH3COO-)<c(Na+)
D.c(CH3COO-)与c (Na+)之间关系不确定
参考答案:A
本题解析:
本题难度:一般
5、选择题 在25 ℃时,将pH = 11的NaOH溶液与pH = 3的CH3COOH溶液等体积混合后,下列关系式中正确的是 ( )
A.c(Na+) = c(CH3COO-)+c(CH3COOH)
B.c(H+) = c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
|