1、实验题 某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究。
(1)[提出假设]向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;?
假设三:反应后固体中____________?_____,证明?。
(2)[定性研究]?
为验证假设三是否成立,兴趣小组进行如下研究,请你完成下表中内容
实验步骤(不要求写出具体操作过程)
| 预期的实验现象和结论
|
取反应后的固体放入试管中,……
| ?
|
?
(3)[定量研究]通过测量气体的体积判断发生的化学反应,实验装置如下:
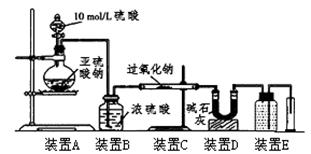
①装置D的作用是?。
②实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据进行判断
SO2被氧化的程度
| V与m1或m2的关系
|
完全被氧化
| V=0
|
部分被氧化
| ??
|
未被氧化
| ??
|
?
参考答案:(1)固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化(每空2分,共4分)
(2)
实验步骤(不要求写出具体操作过程)
预期的实验现象和结论
取反应后的固体放入试管中,加少量水溶解,加入BaCl2溶液,再加入稀盐酸。
加入BaCl2溶液有白色沉淀产生,加入盐酸沉淀部分溶解。
证明原固体中既有亚硫酸钠也有硫酸钠。
(其他合理答案均可,如先加足量盐酸,再加BaCl2溶液)(每空2分,共4分)
(3)①吸收未反应的SO2。(共2分)
②
SO2被氧化的程度
V与m1或m2的关系
完全被氧化
V=0
部分被氧化
0<V<7m1/30 或m1>30V/7?
未被氧化
V=7m1/30或m1=30V/7
(每空2分,共4分)
本题解析:(1)固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化;
(2)要证明假设3是否成立,就是要证明Na2SO3和Na2SO4存在,可以取反应后的固体放入试管中,加少量水溶解,加入BaCl2溶液,再加入稀盐酸。若加入BaCl2溶液有白色沉淀产生,加入盐酸沉淀部分溶解,则证明原固体中既有亚硫酸钠也有硫酸钠。
(3)①D的作用吸收未反应的SO2。
②若Na2SO3未被氧化发生的反应只有2Na2O2+2SO2=2Na2SO3+O2根据差量法得到V=7m1/30或m1=30V/7,若部分被氧化发生的反应还有Na2O2+SO2=Na2SO4,该反应中SO2全部转化为固体的质量,没有气体生成,这个时候固体的质量增大,可知0<V<7m1/30 或m1>30V/7。
本题难度:困难
2、计算题 在标准状况下,将SO2和Cl2气体混合,测得混合气体相对HCl的密度是1.85。将该混合气体2.24L溶于100mL水中制成溶液,已知该溶液的密度为1.05? g/cm3。(已知:SO2+Cl2+2H2O=H2SO4+2HCl)计算该混合溶液中H+的物质的量浓度。(计算最终结果保留两位小数)
参考答案:1.97mol/L(6分)
本题解析:略
本题难度:一般
3、实验题 (12分)某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示的装置进行有关实验。请回答:

(1)装置A中发生的化学反应方程式为?。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是?,其作用是?。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是?。B中应放置的液体是?(填字母)。
a. 水? b. 酸性KMnO4溶液? c. 浓溴水? d. 饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol·L-1的浓硫酸放在圆底烧瓶中共热,直 到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是?。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是?(填字母)。
a. 铁粉? b. BaCl2溶液? c. 银粉? d. Na2CO3溶液
参考答案:(12分)
(1) ?Cu+2H2SO4==CuSO4+SO2↑+2H2O?。
(2) ?NaOH溶液?,?吸收S O2尾气?。
O2尾气?。
(3) ?广口 瓶B中液体被压入漏斗中?
瓶B中液体被压入漏斗中? ?。?d.?。
?。?d.?。
(4)?①?反应变成稀硫酸后不与铜反应?。?②? a.? d?
本题解析:略
本题难度:一般
4、选择题 把含硫48%的硫铁矿先制成硫酸,再吸收氨气制成硫酸铵。1 t这种硫铁矿在理论上能制得硫酸铵()
A.1.06 t
B.1.98 t
C.2.14 t
D.2.26 t
参考答案:B
本题解析:FeS2中的S的含量为 ×100%=53.3%,而题目中所提供的硫铁矿中含硫48%,所以不能以FeS2进行计算,需根据矿石的含硫量及S原子守恒得关系式:
×100%=53.3%,而题目中所提供的硫铁矿中含硫48%,所以不能以FeS2进行计算,需根据矿石的含硫量及S原子守恒得关系式:
2S~2SO2~2SO3~2H2SO4~2(NH4)2SO4
64 t? 2×132 t
1 t×48%?m〔(NH4)2SO4〕
m〔(NH4)2SO4〕="1.98" t
本题难度:简单
5、填空题 (10分)、硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~900℃时,硫铁矿在纯净的氧气中煅烧,可能发生下列反应:
① 3FeS2+8O2→Fe3O4+6SO2?② 4FeS2+11O2→2Fe2O3+8SO2?
⑴为使FeS2煅烧完全生成Fe2O3,使用过量氧气,当氧气过量20%时,求所得炉气中SO2的体积分数。(写出计算过程)
⑵480 g纯净的FeS2在氧气中完全反应,若所得固体中,Fe和O的物质的量之比
n(Fe)∶n(O)=4∶a,此时消耗氧气b mol。
①试写出b与a的关系式:_______?______。
② b的最大值为?____,最小值为_______?____。
参考答案:(1)78.4%(5分)
设生成8 L SO2,则原氧气为11×1.2=13.2(L),反应后混合气体积为10.2 L。
SO2%=8/10.2=78.4%
(2)①b=0.5a+8(3分)?②b=11(3分),b=10.7?即:32/3(3分)
本题解析:(1)根据方程式② 4FeS2+11O2→2Fe2O3+8SO2分析可知,每11mol氧气与FeS2反应生成8mol二氧化硫气体,所以,令氧气的物质的量为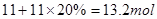 ,当与4molFeS2反应生成8mol二氧化硫气体时,余下氧气20%,所以可求得炉气中SO2的体积分数
,当与4molFeS2反应生成8mol二氧化硫气体时,余下氧气20%,所以可求得炉气中SO2的体积分数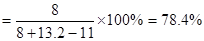
(2)480 g纯净的FeS2的物质的量为4mol;令Fe3O4的物质的量为x,Fe2O3的物质的量为y,则由化学反应方程式可得:
① 3FeS2+8O2→Fe3O4+6SO2
3x? 8x? x
② 4FeS2+11O2→2Fe2O3+8SO2
2y? 5.5y? y
根据Fe元素守恒可得:3x+2y=4;固体中O元素的质量为:4x+3y=a;由方程式中消耗氧气的物质的量为:8x+5.5y=b;解这三个方程式可求得b与a的关系式:b=0.5a+8;
由方程式中的比例关系可知,b的最大值为b=11;b的最小值为32/3
本题难度:一般