1、选择题 下列关于SO2的说法中,不正确的是
A.SO2是硫及某些含硫化合物在空气中燃烧的产物
B.SO2具有漂白性,可以使品红溶液褪色
C.SO2与水反应生成H2SO4
D.SO2是一种大气污染物,它主要来自于化石燃料的燃烧
参考答案:C
本题解析:
答案:C
C.不正确,SO2与水反应生成H2SO3;
硫及某些含硫化合物,化石燃料的燃烧,都产生SO2,是大气污染物,是酸性氧化物,能与水、碱、部分氧化剂、还原剂反应,具有漂白性,可以使品红溶液褪色。A、D、B均正确。
本题难度:一般
2、选择题 在V mL硫酸铝溶液中含有Al3+m g,取该溶液 ?mL,用水稀释至4V mL,则溶液中SO
?mL,用水稀释至4V mL,则溶液中SO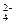 的物质的量浓度为
的物质的量浓度为
A.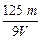 mol·L-1
mol·L-1
B. mol·L-1
mol·L-1
C.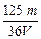 mol·L-1
mol·L-1
D.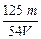 mol·L-1
mol·L-1
参考答案:C
本题解析:据题 ?mL溶液里含Al3+
?mL溶液里含Al3+ ?g,则:n(Al3+)=
?g,则:n(Al3+)=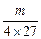 ?mol,所以c(Al3+)=
?mol,所以c(Al3+)=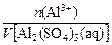 =
=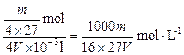 ,则c(SO
,则c(SO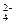 )=
)=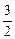 ×c(Al3+)=
×c(Al3+)=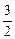 ×
× ?mol·L-1。
?mol·L-1。
本题难度:简单
3、填空题 SO2是一种重要的化工原料,也是一种环境污染物。
(1)SO2可用于工业制Br2过程中吸收潮湿空气中的Br2,反应的离子方程式是? 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的反应:?。
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol?L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
①此时溶液中c(SO32-)的浓度是0.2 mol?L-1,则溶液中c(HSO3-)是_________mol?L-1,由此说明NaHSO3溶液显?性,用化学平衡原理解释:?。
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是?。
参考答案:(1)SO2 + Br2 + 2H2O = SO42—+ 2Br—+ 4H+;(2)SO2 + H2O 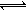 ?H2SO3;2H2SO3 + O2 = 2H2SO4(3)①1.6;酸;NaHSO3溶液中存在HSO3—
?H2SO3;2H2SO3 + O2 = 2H2SO4(3)①1.6;酸;NaHSO3溶液中存在HSO3—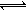 ?H+ + SO32—和 HSO3— + H2O
?H+ + SO32—和 HSO3— + H2O 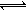 ?H2SO3 + OH—,HSO3—的电离程度大于其水解程度② 2NaHSO3 + O2 = Na2SO4 + H2SO4
?H2SO3 + OH—,HSO3—的电离程度大于其水解程度② 2NaHSO3 + O2 = Na2SO4 + H2SO4
本题解析:(1)SO2发生氧化反应生成SO42—而Br2被还原为Br—,反应离子方程SO2+Br2+2H2O= SO42—+2Br—+4H+;(2)氧化硫是酸性氧化物,和水反应生成亚硫酸,亚硫酸不稳定能被空气中的氧气氧化生成硫酸,反应方程 91ExAM.org式为SO2+H2O H2SO3;2H2SO3+O2=2H2SO4(3)①向Na2SO3溶液中通入SO2生成NaHSO3,反应方程式SO2+Na2SO3+2H2O=2NaHSO3,溶液中反应的硫酸根离子和生成硫酸氢跟离子的物质的量比为1:2,即溶液中参加反应的硫酸根为(1.0-0.2)mol?L-1,则生成的硫酸氢跟为2(1.0-0.2)mol?L-1="1.6" mol?L-1,硫酸氢跟电离产生氢离子,且电离程度大于水解程度,故溶液显酸性,NaHSO3溶液中存在HSO3—
H2SO3;2H2SO3+O2=2H2SO4(3)①向Na2SO3溶液中通入SO2生成NaHSO3,反应方程式SO2+Na2SO3+2H2O=2NaHSO3,溶液中反应的硫酸根离子和生成硫酸氢跟离子的物质的量比为1:2,即溶液中参加反应的硫酸根为(1.0-0.2)mol?L-1,则生成的硫酸氢跟为2(1.0-0.2)mol?L-1="1.6" mol?L-1,硫酸氢跟电离产生氢离子,且电离程度大于水解程度,故溶液显酸性,NaHSO3溶液中存在HSO3—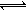 ?H+ + SO32—和 HSO3— + H2O
?H+ + SO32—和 HSO3— + H2O 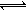 ?H2SO3 + OH—,HSO3—的电离程度大于其水解程度②向NaHSO3溶液中通入氧气,可将亚硫酸根离子氧化为硫酸根离子,反应方程式2NaHSO3 + O2 = Na2SO4 + H2SO4。
?H2SO3 + OH—,HSO3—的电离程度大于其水解程度②向NaHSO3溶液中通入氧气,可将亚硫酸根离子氧化为硫酸根离子,反应方程式2NaHSO3 + O2 = Na2SO4 + H2SO4。
本题难度:一般
4、选择题 下列关于浓硝酸和浓硫酸的叙述中正确的是
A.常温下均可用铝制容器运输
B.露置在空气中,容器内酸液质量都减小
C.常温下均能与铜较快反应
D.露置在空气中,容器内酸液质量都增大
参考答案:A
本题解析:A选项,铝与浓硝酸浓硫酸钝化,故能够使用铝制容器运输。B选项,浓硫酸具有吸收性,酸液质量增加,错误。C选项,常温下,浓硫酸不与铜发生反应。D选项,浓硝酸挥发,暴露在空气中,硝酸溶液质量减少。错误。
本题难度:一般
5、填空题 对绿矾晶体加强热,全部反应后将生成的混合气体通入浓BaCl2溶液中,生成硫酸钡白色沉淀,同时放出能使品红溶液褪色的气体,过滤沉淀后得浅黄色溶液。试写出绿矾晶体分解的化学方程式?。最后获得的浅黄色溶液中所含的溶质有?。
参考答案:2FeSO4  ?Fe2O3+SO2↑+SO3↑?Fe2(SO4)3?和FeCl3
?Fe2O3+SO2↑+SO3↑?Fe2(SO4)3?和FeCl3
本题解析:晶体全部分解,生成的混合气体与BaCl2溶液反应生成硫酸钡白色沉淀,说明混合气体溶于水生成了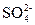 ,可判定混合气体中有SO3生成。分解生成的能使品红试液褪色的气体应为SO2。最后所得浅黄色溶液必定是含Fe3+的溶液,据此可推知绿矾晶体分解生成了+3价的铁。根据质量守恒,该反应的化学方程式为2FeSO4
,可判定混合气体中有SO3生成。分解生成的能使品红试液褪色的气体应为SO2。最后所得浅黄色溶液必定是含Fe3+的溶液,据此可推知绿矾晶体分解生成了+3价的铁。根据质量守恒,该反应的化学方程式为2FeSO4  ?Fe2O3+SO2↑+SO3↑。过滤沉淀,最后所得的浅黄色溶液为Fe2(SO4)3和FeCl3的混合物。
?Fe2O3+SO2↑+SO3↑。过滤沉淀,最后所得的浅黄色溶液为Fe2(SO4)3和FeCl3的混合物。
本题难度:简单