1、填空题 如图每一方框中的字母代表一种反应物或生成物。产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白。
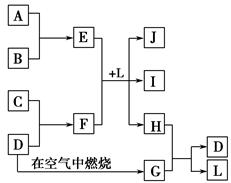
(1)框图中所列物质中属于非电解质的物质的化学式是?。
(2)用电子式表示出H的形成过程?。
(3)将E的水溶液蒸干并灼烧得到的固体物质的化学式为?。
(4)F的水溶液中各离子浓度由大到小的顺序为?。
(5)F的水溶液显碱性的原因:?(用离子方程式表示)。
(6)E与F在L中反应的离子方程式为?。
(7)H和G之间反应的化学方程式为?。
参考答案:(1)SO2
(2) 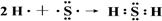
(3)Al2O3
(4)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
(5)S2-+H2O?HS-+OH-
(6)2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
(7)2H2S+SO2=3S↓+2H2O
本题解析:根据J是含金属元素A的白色胶状沉淀,可推断出A是Al,J是Al(OH)3;根据D是淡黄色固体单质,可推断出D为S。从图示转化关系知,E是含铝的化合物,F是含硫的化合物,结合I为NaCl溶液,可以推断出E是AlCl3、F是Na2S、L是H2O,则B 为Cl2,C为Na。G是SO2,结合SO2的性质及G与H的反应,可推断出H是H2S。(1)框图中只有SO2为非电解质。(3)AlCl3蒸干时水解得到Al(OH)3,灼烧最终得到Al2O3。(4)Na2S溶液中由于S2-水解溶液显碱性,离子浓度大小为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。(5)S2-水解的离子方程式为S2-+H2O HS-+OH-。(6)Al3+与S2-发生相互促进的水解反应:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。(7)该反应为硫元素的归中反应:2H2S+SO2=3S↓+2H2O。
HS-+OH-。(6)Al3+与S2-发生相互促进的水解反应:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。(7)该反应为硫元素的归中反应:2H2S+SO2=3S↓+2H2O。
本题难度:一般
2、选择题 能证明SO2具有漂白性的是
A.酸性KMnO4溶液中通入SO2气体后溶液褪色
B.滴入酚酞的NaOH溶液中通入SO2气体红色消失
C.品红溶液中通入SO2气体红色消失
D.溴水中通入SO2气体后溶液褪色
参考答案:C
本题解析:A、酸性KMnO4溶液中通入SO2气体后溶液褪色,证明二氧化硫具有还原性,错误;B、滴入酚酞的NaOH溶液中通入SO2气体红色消失,证明二氧化硫的水溶液显酸性,与氢氧化钠发生中和反应,错误;C、品红溶液中通入SO2气体红色消失,证明二氧化硫具有漂白性,正确;D、溴水中通入SO2气体后溶液褪色证明二氧化硫具有还原性,错误,答案选C。
本题难度:一般
3、实验题 为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置。
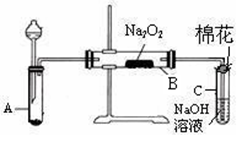
回答下列问题:
(1)制取SO2的合适试剂是 ?。
a.80%的H2SO4(aq)?b.10%的H2SO4(aq)?
c.Na2SO3(s)?d.Na2SO3(aq)?
(1)装置C中NaOH(aq)的作用是?。
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃。甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式?。
(1)检验反应后B装置中生成物的方法是?。
(1)乙同学认为无论反应原理如何,最终都有O2产生。乙同学的理由是?。按照乙同学的观点,该装置还需作如下改进:?。(简要阐述,并指明必需的装置名称与试剂。)
参考答案:(1)a、c(1分×2)?
(2) 吸收多余的SO2,防止污染环境(1分×2)
(3)SO2+?Na2O2→ Na2SO4(2分)
(4)取少量B中固体于试管中,加盐酸至溶液呈酸性,再滴入氯化钡溶液,若有白色沉淀生成,则B中反应后的生成物里有Na2SO4(2分)
(5)A中生成的SO2气体中含有水蒸气(2分)。在A和B之间连接一个装有浓硫酸的洗气瓶(或其他合适的干燥装置)。合理给分。?(2分)
本题解析:(1)因SO2的溶解度较大,应选用浓度较大的H2SO4溶液;为了使反应顺利进行须选择Na2SO3固体与硫酸反应(CaSO3固体与硫酸反应生成的硫酸钙微溶于水).故答案为:bc(2)SO2有毒,直接排放到空气中污染环境.故答案为:吸收多余的SO2,防止污染环境(3)进入B装置的气体应该干燥,故应将②加在A和B之间.故答案为:②;将②加在A和B之间(4)木条不复燃,说明没有氧气生成,Na2O2有强氧化性,有SO2较强的还原性,产物应为Na2SO4,方程式为:SO2+Na2O2=Na2SO4.故答案为:SO2+Na2O2=Na2SO4
(5)在检验是否有Na2SO4生成时,要考虑到Na2SO3的干扰,因为SO32-有较强的还原性,可被过氧化钠氧化成SO42-.故答案为:不合理;如果固体中还有未反应的Na2O2,也能氧化亚硫酸钠为硫酸钠.(6)将Na2SO4转化成BaSO4沉淀,通过称量BaSO4沉淀的质量,计算含量,故应为acd。故答案为:acd
本题难度:困难
4、选择题 向100 mL含等物质的量的HBr和H2SO3的溶液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr的物质的量浓度为(? )
A.0.007 5 mol·L-1
B.0.008 mol·L-1
C.0.075 mol·L-1
D.0.08 mol·L-1
参考答案:D
本题解析:已知Br2能氧化H2SO3,说明H2SO3的还原性比Br-强,通入的Cl2先与H2SO3发生反应:Cl2+H2SO3+H2O====2HCl+H2SO4,然后再与Br-发生反应:Cl2+2Br-====2Cl-+Br2。设H2SO3的物质的量为x,则有x+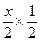 ="0.01" mol,解得x="0.008" mol,所以c (H2SO3)=" c" (HBr)=" 0.08" mol·L-1。
="0.01" mol,解得x="0.008" mol,所以c (H2SO3)=" c" (HBr)=" 0.08" mol·L-1。
本题难度:简单
5、选择题 往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时产生白色沉淀。下列有关说法中不正确的是(?)
A.白色沉淀为BaSO4
B.反应后溶液的pH减小
C.此实验表明SO2有漂白性
D.此实验中Fe3+表现出氧化性
参考答案:C
本题解析:涉及反应为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+? SO42-+Ba2+=BaSO4↓
可见反应后生成了强酸,酸性增强,pH减小,Fe3+在反应中表现氧化性,SO2表现还原性
C符合题意
本题难度:一般