1、选择题 浓硫酸有许多重要的性质,在与含有永分的蔗糖作用过程中不能显示的性质是
A.酸性
B.脱水性
C.强氧化性
D.吸水性
参考答案:A
本题解析:
答案:A
根据浓硫酸与蔗糖反应的现象可以推出其显示的性质,浓硫酸可吸收蔗糖中的水,可使蔗糖脱水成碳,与碳反应生成二氧化碳和二氧化硫,这些分别表现了浓硫酸的吸水性、脱水性和强氧化性。
本题难度:一般
2、选择题 下列气体:①NH3 ②NO2 ③NO ④O2 ⑤SO2中,适于用下图装置制取和收集的气体是
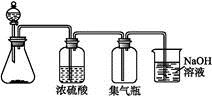
A.①②
B.②③
C.③④
D.②⑤
参考答案:D
本题解析:NH3不能用浓硫酸干燥,NO不能用排空气法收集,O2不需要尾气处理装置。
本题难度:一般
3、填空题 某工厂排放的废水中含有游离的氯,为了除去游离氯,且使废水变为中性,有人提出如下图方案,在废水排出口的A、B处分别注入一定流量的废烧碱溶液和亚硫酸钠溶液,已知Cl2与Na2SO3发生反应:Cl2+Na2SO3+H2O====2HCl+Na2SO4。

试写出:
(1)A、B处应加入的物质分别是:A___________,B___________。(写化学式)
(2)写出反应的离子方程式:A___________________________,
B____________________________________________________________。
参考答案:(1)Na2SO3? NaOH
(2)Cl2+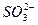 +H2O====2H++2Cl-+
+H2O====2H++2Cl-+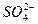 ? H++OH-====H2O
? H++OH-====H2O
本题解析:题目要求除去游离氯(Cl2),且使废水变为中性,Cl2具有强氧化性,用还原剂Na2SO3除去,根据题给信息,Cl2与Na2SO3反应后产生酸液,可用废烧碱(NaOH)中和,因此上游A处应加入Na2SO3,下游B处加入废烧碱。
本题难度:简单
4、实验题 某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。
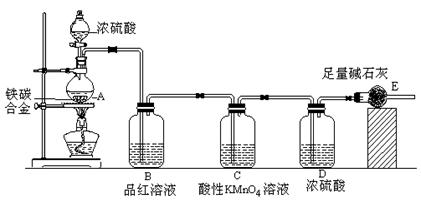
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是①常温下碳与浓硫酸不反应;②?。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式?。
(3)B中的现象是:?;
C的作用是:?。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为??(写含m、b的表达式)。
⑸反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
A:只含有Fe3+;B:只含有Fe2+;C:?。
验证C的实验方法是?
?。
参考答案:(1)?常温下Fe遇浓硫酸发生钝化?(1分)
(2) C + 2H2SO4(浓)  ?CO2↑ + 2SO2↑ + 2H2O(2分)
?CO2↑ + 2SO2↑ + 2H2O(2分)
(3) 品红溶液褪色,或“颜色变浅” (1分) 除尽反应产物中的SO2气体?(1分)
(4)(11m-3b)/11m?(2分)
⑸既有Fe3+又有Fe2+?(1分)
取试样少许于试管中,先滴加少量的KSCN溶液,振荡后溶液显红色证明有Fe3+?(1分);再取试样少许于另一支试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+(1分)。?(2分,检验Fe3+ 1分,检验Fe2+ 1分)
本题解析:(1)依据铁在常温下在浓硫酸中钝化,碳和浓硫酸需要加热反应分析可知,往铁碳合金中加入浓硫酸,未点燃酒精灯前,A、B均无明显现象。
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,则化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,
CO2↑+2SO2↑+2H2O,
(3)气体中含有二氧化硫,通过品红溶液会褪色,通过高锰酸钾溶液可以除去二氧化硫,避免干扰二氧化碳的测定。
(4)根据CO2+Ca(OH)2=CaCO3↓+H2O,E增重b g,可算出碳的质量有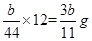 ?g,则铁的质量分数:
?g,则铁的质量分数: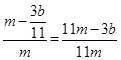
(5)由A、B假设可推出C假设为:既有Fe3+又有Fe2+;可用KSCN检验Fe3+、然后用酸性KMnO4溶液检验Fe2+。
本题难度:困难
5、选择题 下列实验能证明某无色气体一定为SO2的是(?)
①能使澄清石灰水变浑浊?②能使湿润的蓝色石蕊试纸变红?③能使品红试液褪色,加热后又显红色?④通入足量NaOH溶液中,再滴加BaCl2溶液,有白色沉淀产生,该沉淀溶于稀盐酸?⑤能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生
A.都能证明
B.都不能证明
C.③⑤
D.③④⑤
参考答案:C
本题解析:①④中也可能是CO2,②中也可能是氯化氢等。SO2具有品红溶液,同时也具有还原性,所以正确的选C。
本题难度:简单