1、选择题 若氧元素只有16O、18O两种核素,下列说法正确的是
A.16O2与18O2互为同位素
B.用石墨电极电解含有一定量H218?O的普通水时,阳极可能产生三种相对分子质量不同的氧分子
C.20g H218O中含有12mol质子
D.SO3中的三个S-O键是等同的,向 2SO2(g) + O2(g)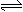 2SO3(g) 的平衡体系中加入18?O2,达到新的平衡后18?O2只出现在O2与SO3中
2SO3(g) 的平衡体系中加入18?O2,达到新的平衡后18?O2只出现在O2与SO3中
参考答案:B
本题解析:A错,16O与18O互为同位素,同位素是指质子数相同,中子数不同的同一元素的不同原子互称为同位素。
B正确,电解含有一定量H218?O的普通水时,阳极为18?O H—、16?OH—放电生成氧气,但生成的氧气有:18?O 2、16?O 2、16?O 18?O三种气体。
C错,20g? H218O的物质的量为1mol,其含有质子为10mol
D错,该反应为可逆反应,达到新的平衡后18?O2出现在O2与SO3、SO2
本题难度:一般
2、选择题 下列关于碱金属元素和卤素的说法中,错误的是(?)
A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钠与水的反应不如钾与水的反应剧烈
D.溴单质与水的反应比氯单质与水的反应更剧烈
参考答案:D
本题解析:从上到下,卤素单质的氧化性逐渐减弱,非金属性逐渐减弱,所以溴单质与水反应不如氯单质与水反应剧烈,所以D项错误。
本题难度:一般
3、选择题 有三种短周期元素分别为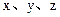 ,已知
,已知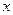 元素的原子最外层只有一个电子,
元素的原子最外层只有一个电子, 元素原子最外层电子数是其内层电子数的2倍,
元素原子最外层电子数是其内层电子数的2倍,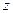 是地壳中含量最高的元素,则这三种元素所组成的化合物的化学式不可能是(?)
是地壳中含量最高的元素,则这三种元素所组成的化合物的化学式不可能是(?)
A.x2yz3
B.x4y2z2
C.x3yz4
D.x6y2z
参考答案:C
本题解析:略
本题难度:简单
4、选择题 如果发现了原子序数为116的元素,对它的描述正确的是(? )
①位于第7周期?②是非金属元素?③最外电子层含有6个电子?④没有放射性?⑤属于氧族元素?⑥属于卤素
A.①③⑤
B.①③⑥
C.②④⑥
D.②③⑤
参考答案:A
本题解析:116号元素位于第7周期ⅥA族,属于氧族元素,为金属元素,具有放射性。
本题难度:简单
5、填空题 利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第三周期,两种元素原子的质子数之和为27,则R的原子结构示意图为________。
②常温下,不能与M单质发生反应的是________(填序号)。
a.CuSO4溶液? b.Fe2O3? c.浓硫酸? d.NaOH溶液? e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g) H2(g)+
H2(g)+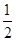 S2(g)
S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:____________________________________。

②电化学法
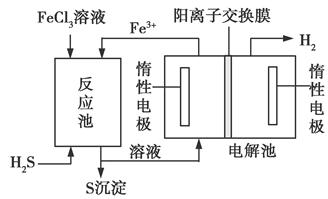
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是______________________________;
反应池中发生反应的化学方程式为____________________。反应后的溶液进入电解池,电解总反应的离子方程式为_______________。
参考答案:(1)①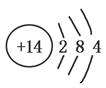 ②b、c
②b、c
(2)① 温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案)
温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案)
②增大反应物接触面积,使反应更充分 H2S+2FeCl3=2FeCl2+S↓+2HCl 2Fe2++2H+ 2Fe3++H2↑
2Fe3++H2↑
点拨:知识:元素推断、元素化合物性质、平衡常数、电解时离子方程式的书写。能力:读图能力、计算能力、分析问题并解决问题能力、知识的灵活运用能力。试题难度:中等。
本题解析:运用无机材料的化学式推断元素的化合价,是解决(1)小题的突破口。
①根据元素M、R均位于第三周期,且质子数之和为27,无机材料中M的化合价为+3,R的化合价为+4,可得M、R分别为Al、Si,则R的原子结构示意图为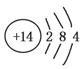 ;铝与三氧化二铁只能在高温下反应;铝与碳酸钠固体在常温下不反应;铝与硫酸铜溶液在常温下发生置换反应;常温下铝在浓硫酸中形成致密的氧化膜(钝化);铝与氢氧化钠溶液反应放出氢气。
;铝与三氧化二铁只能在高温下反应;铝与碳酸钠固体在常温下不反应;铝与硫酸铜溶液在常温下发生置换反应;常温下铝在浓硫酸中形成致密的氧化膜(钝化);铝与氢氧化钠溶液反应放出氢气。
(2)①由图知,985℃时H2S的平衡转化率为40%,则:
H2S(g) H2(g)+
H2(g)+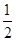 S2(g)
S2(g)
起始时浓度(mol·L-1)? c?0?0
平衡时浓度(mol·L-1)? 0.6c?0.4c?0.2c
则K=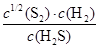 =
=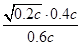 =
=
b曲线表示未达到平衡时H2S的转化率,温度越高,b曲线上的转化率越接近平衡值,原因是温度升高,反应速率加快,达到平衡所需的时间缩短。
②采用气、液逆流方式的目的是增大反应物接触面积,使反应更充分。反应池内发生反应的化学方程式为H2S+2FeCl3=2FeCl2+S↓+2HCl。进入电解池的物质应为FeCl2和HCl,根据电解池图示,左侧生成的为Fe3+,右侧生成的为H2,则可得总反应的离子方程式:2Fe2++2H+ 2Fe3++H2↑。
2Fe3++H2↑。
本题难度:一般