1、填空题 (9分).有A、B、C、D、E五种短周期元素,其中A、C、B属于同一周期,且原子序数依次增大;A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式为:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号)。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。
参考答案:(1)1s22s22p63s23p2 (2)  ?
?
(3)N ? O (4)三角锥形 sp3杂化? (5)2 ? H2O ? SiH4
本题解析:根据元素的结构及有关性质可知,A、B、C、D、E五种短周期元素分别是C、O、N、Si、S。
(1)根据构造原理可知,硅元素基态原子的电子排布式1s22s22p63s23p2。
(2)CO2是含有极性键的直线型结构,所以电子式是 。
。
(3)由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能大于氧元素的。
(4)在NH3中中心原子氮原子含有的孤对电子对数是(5-1×3)÷2=1,所以氨气是三角锥形。
(5)氮气中含有氮氮三键,而三键是由1个α键和2个π键构成的,所以氨气中含有的π键数目是2个;非金属性越强,相应氢化物的稳定性越强,因此水的稳定性强于SiH4的。
本题难度:一般
2、选择题 X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
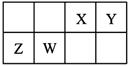
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
参考答案:B
本题解析:根据元素在周期表中的相对位置可知,Z位于第三周期。由于Z元素原子核外K层与M层电子数相等,所以Z是Mg元素,则W是Al,X是C,Y是N。A、氮元素的在最高价是+5加÷价,所以N元素最高价氧化物对应的水化物化学式为HNO3,A不正确;B、同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,因此四种元素的原子半径由小到大的顺序为:Y<X<W<Z,B周期;C、在常温下铝在浓硝酸中发生钝化,不能溶解在浓硝酸中,C不正确;D、氧化镁含有离子键,CO2中含有极性键,化学键类型不同,D不正确,答案选B。
本题难度:一般
3、选择题 下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是
①微粒半径:S2->Cl->Cl>S ?②氢化物稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-?④氧化性:Cl2>S>Se
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥得电子能力:F>Cl>Br>I
A.只有①
B.②④⑥
C.①③④
D.只有⑥
参考答案:B
本题解析:根据元素周期律可知,①不正确,微粒半径应该是S2->Cl- >S>Cl;非金属性越强,氢化物的稳定性越强,②正确;非金属性越强,相应阴离子的还原性越弱,③不正确,还原性应该是S2->I->Br->Cl-;非金属性越强,相应单质的氧化性越强,④正确;非金属性越强,最高价氧化物的水化物的酸性越强,⑤不正确,应该是HClO4>H2SO4> H2SeO4;同主族自上而下,非金属性逐渐减弱,⑥正确,答案选B。
点评:该题是高考中的高频题,属于中等难度的试题,试题综合性强,主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律知识解决实际问题有的能力,有助于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。
本题难度:一般
4、填空题 (10分)有A、B、C、D、E五种短周期主族元素,A、B、C、D原子序数依次增大,原子半径按D、A、B、C、E依次减小,A、B的核电荷数之和等于D的核电荷数,D的最外层电子数为C的最外层电子数的一半,E可以分别与A、B、C形成电子总数相同的共价分子。
⑴写出元素D在周期表中的位置?。
⑵元素A的非金属?(填“>”或“<”)元素C
⑶C离子与D离子的电子数相等,比较这两种离子的半径大小:C离子?(填“>”或“<”)D离子
⑷写出由元素A和元素E组成的10电子分子的电子式?。
⑸氧化铜与D的单质在高温下发生化学反应的方程式?
?,若得到1mol氧化产物,则该反应转移电子?mol。取该反应的还原产物3.2g与12.5mL、8mol/L的硫酸溶液(98%的硫酸其物质的量的浓度为18mol/L)混合,按右图装置进行实验,实验发现,3.2g还原产物几乎被消耗掉,请你解释其原因?。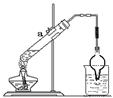
参考答案:⑴第三周期ⅢA族?⑵<?⑶>⑷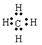 ⑸3CuO+2Al
⑸3CuO+2Al Al2O3+3Cu?6 由于酒精灯一直在加热,随着反应进行,反应生成的水不断蒸发,Cu和硫酸的反应在持续进行,而Cu和H2SO4的物质的量之比又恰好是1:2。
Al2O3+3Cu?6 由于酒精灯一直在加热,随着反应进行,反应生成的水不断蒸发,Cu和硫酸的反应在持续进行,而Cu和H2SO4的物质的量之比又恰好是1:2。
本题解析:根据“A、B、C、D原子序数依次增大,原子半径按D、A、B、C、E依次减小”,可以确定,E为第一周期,H;A、B、C为第二周期;E为第三周期。“A、B的核电荷数之和等于D的核电荷数,D的最外层电子数为C的最外层电子数的一半”,可以确定C的最外层电子数为偶数,D为奇数,又因为A、B、C与H结合为10电子物质,确定A、B、C为C、N、O;D为Al。最终确定A、B、C、D、E依次为C、N、O、Al、H。
(1)铝核外有三个电子层,最外层有3个电子,铝在周期表中的位置是第三周期第IIIA族。
(2)C和O都是第二周期元素,从左向右,非金属增强。
(3)电子层结构相同的离子,核电荷数越大,离子半径越小。
(4)C和H组成的10电子分子为甲烷分子。
(5)铝和氧化铜高温下发生铝热反应,方程式为3CuO+2Al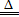 Al2O3+3Cu,若得到1mol氧化铝,转移电子6mol。铜与硫酸物质的量比为1:2,反应持续加热,水不断蒸发,铜与浓硫酸可完全反应。
Al2O3+3Cu,若得到1mol氧化铝,转移电子6mol。铜与硫酸物质的量比为1:2,反应持续加热,水不断蒸发,铜与浓硫酸可完全反应。
点评:熟记1~18号元素符号及其名称。
本题难度:一般
5、选择题 某阳离子Mn+的核外共有x个电子,核内有a个中子,则M的质量数为?
A.a+x-n
B.a+x+n
C.a-x-n
D.a-x+n
参考答案:B
本题解析:阳离子Mn+的核外共有x个电子,则该微粒的质子数=x+2。又因为质子数+中子数=质量数,则质量数=x+2+a,答案选B。
点评:该题是高考中的常见题型,试题以核燃料为载体,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。
本题难度:一般