1、填空题 (9分).有A、B、C、D、E五种短周期元素,其中A、C、B属于同一周期,且原子序数依次增大;A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式为:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号)。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。
2、选择题 X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
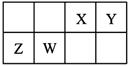
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
3、选择题 下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是
①微粒半径:S2->Cl->Cl>S ?②氢化物稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-?④氧化性:Cl2>S>Se
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥得电子能力:F>Cl>Br>I
A.只有①
B.②④⑥
C.①③④
D.只有⑥
4、填空题 (10分)有A、B、C、D、E五种短周期主族元素,A、B、C、D原子序数依次增大,原子半径按D、A、B、C、E依次减小,A、B的核电荷数之和等于D的核电荷数,D的最外层电子数为C的最外层电子数的一半,E可以分别与A、B、C形成电子总数相同的共价分子。
⑴写出元素D在周期表中的位置?。
⑵元素A的非金属?(填“>”或“<”)元素C
⑶C离子与D离子的电子数相等,比较这两种离子的半径大小:C离子?(填“>”或“<”)D离子
⑷写出由元素A和元素E组成的10电子分子的电子式?。
⑸氧化铜与D的单质在高温下发生化学反应的方程式?
?,若得到1mol氧化产物,则该反应转移电子?mol。取该反应的还原产物3.2g与12.5mL、8mol/L的硫酸溶液(98%的硫酸其物质的量的浓度为18mol/L)混合,按右图装置进行实验,实验发现,3.2g还原产物几乎被消耗掉,请你解释其原因?。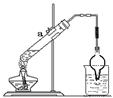
5、选择题 某阳离子Mn+的核外共有x个电子,核内有a个中子,则M的质量数为?
A.a+x-n
B.a+x+n
C.a-x-n
D.a-x+n