1、填空题 (每空1分共5分)
(1)常温下,0.05mol/L硫酸溶液中,c(H+)=?mol/L,pH值为?,水电离的c(H+)=?mol/L
(2)某温度下,纯水中c(H+)=2×10-7mol/L,则纯水中c(OH-)=?mol/L,滴入盐酸使c(H+) ="5" ×10-6mol/L,则c(OH-) =_________mol/L
参考答案:(1)0.1? 1? 1×10—13?(2) 2×10—7?8×10—9
本题解析:
本题难度:简单
2、选择题 下列分别是利用不同能源发电的实例图形,其中不属于新能源开发利用的是
参考答案:C
本题解析:风力、太阳能、潮汐能都是新能源,火力是二次能源。
本题难度:简单
3、填空题 测定石灰石中钙元素的质量百分含量时,都是先把钙元素全部转化为草酸钙沉淀 (CaC2O4?H2O),然后将草酸钙沉淀 (CaC2O4?H2O),用硫酸溶解,用a mol/L的标准高锰酸钾溶液滴定生成的草酸,发生化学反应:H2C2O4 + MnO4- + H+ ?→? Mn2+ + CO2? ↑+ H2O(未配平)。
(1)配平后离子方程式的系数依次为?、?、?、?、?、?。
(2)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、250mL容量瓶外,还需?。
(3)上述实验中的KMnO4溶液需要酸化,不能使用盐酸酸化的原因是?。
(4)开始取用样品的质量为m g,硫酸溶解后所得草酸溶液的体积为100mL,每次取25.00mL进行滴定,达到滴定终点时所耗KMnO4溶液体积为 b mL,所得草酸溶液的物质的量的浓度是?;石灰石中钙元素的质量百分含量为?。(相对原子质量:Ca—40)
参考答案:(19分)(1)5、2、6、2、10、8?(4分)(2)胶头滴管?量筒?(4分)
(3)KMnO4会把Cl-氧化而损耗?(3分)
(4)0.1ab? mol/L;? 40ab/m %或0.4ab/m×100%?(8分)
本题解析:(1)根据方程式可知,在反应中碳元素的化合价从+3价升高到+4价,失去1个电子,则1mol草酸失去2mol电子。Mn元素的化合价从+7价降低到+2价,得到5个电子,即1mol高锰酸钾得到5mol,则根据电子的得失守恒可知,配平后的方程式是5H2C2O4 + 2MnO4- + 6H+ =2Mn2+ + 10CO2 ↑+ 8H2O。
(2)根据一定物质的量浓度溶液配制的要求可知,还缺少的仪器是胶头滴管和量筒。
(3)高锰酸钾具有强氧化性,KMnO4会把Cl-氧化而损耗,所以不能用盐酸酸化。
(4)根据方程式可知,所得草酸溶液的物质的量的浓度是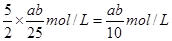 。根据原子守恒可知,石灰石中钙元素的质量百分含量为
。根据原子守恒可知,石灰石中钙元素的质量百分含量为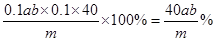 。
。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,贴近高考,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力以及动手操作能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
4、选择题 下列微粒表示正确且能促进H2O的电离的是
A.2H+
B.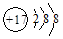
C.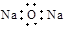
D.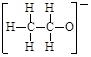
参考答案:D
本题解析:水是弱电解质,存在电离平衡,方程式为H2O H++OH-,因此酸或碱能抑制水的电离,而某些盐能促进水的电离,A是氢离子,抑制水的电离;B是氯离子,既不能促进水的电离,也不能抑制水的电离;C是氧化钠,溶于水生成氢氧化钠,抑制水的电离;D是CH3CH2O-,结合水电离出的氢离子,促进水的电离,答案选D。
H++OH-,因此酸或碱能抑制水的电离,而某些盐能促进水的电离,A是氢离子,抑制水的电离;B是氯离子,既不能促进水的电离,也不能抑制水的电离;C是氧化钠,溶于水生成氢氧化钠,抑制水的电离;D是CH3CH2O-,结合水电离出的氢离子,促进水的电离,答案选D。
本题难度:一般
5、填空题 按要求回答下列问题
(1)某温度下,纯水中c (H+)=2.0×10-7 mol·L-1,则此时c (OH-) =?mol·L-1
0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=_____。
(2)向0.020 mol·L-1的HCN溶液中加入0.020 mol NaCN固体,溶液pH增大,主要原因是?;已知该混合溶液中c (Na+) > c (CN-),则c (HCN)?c (CN-)(用“>”、“<”、“=”符号填空)。
(3)向1L 0.10 mol·L-1的HCN溶液中加入0.08molNaOH固体,得到混合溶液,则_________和__________两种粒子的物质的量之和等于0.1mol;写出该混合溶液中存在的所有平衡的表达式?。
参考答案:(1)2.0×10-7 (2分) ;13 (2分)
(2)CN-浓度增大,抑制了HCN的电离,使C(H+)降低,pH值增大,>(2分)
(3)HCN、 CN-(2分,少答一个不得分);
HCN  ?H++ CN-(1分);H2O
?H++ CN-(1分);H2O  ?H+ + OH-(1分);CN-+ H2O
?H+ + OH-(1分);CN-+ H2O HCN+ OH- (1分);
HCN+ OH- (1分);
本题解析:(1)纯水呈中性,即c (H+)="c" (OH-) =2.0×10-7 mol·L-1,Kw=4.0×10-14,0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合,
c (OH-) =(0.9-0.1)/2=0.4mol/L,故c (H+)="Kw/c" (OH-)=4.0×10-14/0.4mol/L=10-13mol/L,所以pH="-lgc" (H+)=13;(2)向0.020 mol·L-1的HCN溶液中加入0.020 mol NaCN固体,溶液pH增大,主要原因为CN-浓度增大,抑制了HCN的电离,使C(H+)降低,pH值增大,因为c (Na+) > c (CN-),根据电荷守恒c (H+)+c (Na+)="c" (CN-)+c (OH-),,即该溶液层碱性,所以HCN的电离小于水解,即c (HCN)>c (CN-);(3)根据物料守恒,可以知道)HCN、 CN两种粒子的物质的量之和等于0.1mol;该溶液为NaCN和HCN的混合溶液,所以混合溶液中存在的所有平衡的表达式为CN  ?H++ CN-;H2O
?H++ CN-;H2O  ?H+ + OH-;CN-+ H2O
?H+ + OH-;CN-+ H2O HCN+ OH- 。
HCN+ OH- 。
点评:本题综合考查了水的离子积、盐类水解、电荷守恒、质子守恒、pH的计算,有一定的综合性,该题有一定的难度。
本题难度:一般