1、填空题 (6分)(1)常温下将0.2 mol/LHCl溶液与0.2 mol/LMOH溶液等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)__________0.2 mol/LHCl溶液中由水电离出的c(H+);(填“>”“<”或“=”)
(2)常温下若将0.2 mol/LMOH溶液与0.1 mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度;(填“>”“<”或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH__________。(填“>7”“<7”或“无法确定”)
参考答案:(1)>? (2)<? (3)<7
本题解析:(1)0.2 mol/LHCl溶液与0.2 mol/LMOH溶液等体积混合,说明酸碱恰好反应。混合溶液的pH=6,说明水解显酸性,水解促进电离,所以答案是“>”。
(2)0.2 mol/LMOH溶液与0.1 mol/LHCl溶液等体积混合,说明MOH过量,即混合液是由等量的MOH和MCl混合而成的。混合溶液的pH<7,说明MCl的水解程度大于MOH的电离程度。
(3)如果RH是强酸,则显中性。如果是弱酸,则RH过量,溶液显酸性,是由答案是“<7”。
本题难度:一般
2、填空题 Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:

(1)该合成路线对于环境保护的价值在于?。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因?。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:?。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)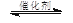 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2) / n(CO2)]
| 500 K
| 600 K
| 700 K
| 800 K
|
1.5
| 45%
| 33%
| 20%
| 12%
|
2.0
| 60%
| 43%
| 28%
| 15%
|
3.0
| 83%
| 62%
| 37%
| 22%
|
?
(4)该反应的焓变△H?0,熵变△S?0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式?。
(6)若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜?g。
参考答案:(1)有利于防止温室效应 (2分)
(2)HOCH2CH2NH2+H2O HOCH2CH2NH3++OH-?(2分)
HOCH2CH2NH3++OH-?(2分)
(3)CO2(g)+3 H2(g)= CH3 OH(l)+ H2O(l) △H=-131.9kJ/mol?(3分)
(4)<? (1分),<? (1分)
(5) CH3 OCH3 -12e-+16 OH-=2CO32-+11 H2O? (3分 )
(6)9.6(2分 )
本题解析:(1)氢气与二氧化碳合成甲醇,减少了二氧化碳的排放,有利于防止温室效应
(2)HOCH2CH2NH2水解使溶液呈碱性,发生的离子方程式为HOCH2CH2NH2+H2O HOCH2CH2NH3++OH-
HOCH2CH2NH3++OH-
(3)根据盖斯定律,将甲醇与氢气的燃烧热化学方程式作相应调整,得△H=-285.8 kJ/mol×3-(-725.5 kJ/mol)=-131.9kJ/mol,所以合成甲醇的热化学方程式为CO2(g)+3 H2(g)= CH3 OH(l)+ H2O(l) △H=-131.9kJ/mol
(4)随温度升高,二氧化碳的转化率降低,说明升温平衡向逆向移动,正反应方向为放热反应,△H<0,反应物气体的总物质的量是8mol,生成物气体的总物质的量是4mol,所以△S<0;
(5)该电池负极是甲醚发生氧化反应,碱性介质中生成碳酸根离子,电极反应式为CH3 OCH3 -12e-+16 OH-=2CO32-+11 H2O
(6)0.5min甲醚的通入量是0.025mol,转移电子是0.3mol,根据得失电子守恒,Cu2++2e-=Cu,最终得0.15mol铜,其质量是9.6g。
本题难度:一般
3、选择题 盐酸、醋酸、碳酸钠和碳酸氢钠是生活中常见的物质,下列表述正确的是?
A.在Na2CO3溶液中加入与其溶质等物质的量的冰醋酸,溶液中存在:
c(Na+) = c(CH3COOH) + c(CH3COO-)+ c(CO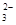 )+c(HCO
)+c(HCO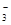 ) + c(H2CO3)
) + c(H2CO3)
B.NaHCO3溶液中存在:c(H+)+c(H2CO3)=c(OH-)
C.10 mL 1.0 mol·L-1CH3COOH溶液中加入0.01 mol的NaOH后,溶液中离子浓度的大小关系为:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
D.相同条件下,中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量前者大
参考答案:A
本题解析:A:由物料守恒可得:
c(Na+) ="2[" c(CO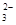 )+c(HCO
)+c(HCO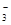 ) + c(H2CO3)] (钠原子是碳原子总数的两倍)
) + c(H2CO3)] (钠原子是碳原子总数的两倍)
c(CO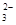 )+c(HCO
)+c(HCO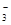 ) + c(H2CO3)= c(CH3COOH) + c(CH3COO-) (碳原子与醋酸的量相等)
) + c(H2CO3)= c(CH3COOH) + c(CH3COO-) (碳原子与醋酸的量相等)
结合两式可得:c(Na+) = c(CH3COOH) + c(CH3COO-)+ c(CO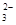 )+c(HCO
)+c(HCO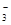 ) + c(H2CO3)
) + c(H2CO3)
B:物料守恒:c(Na+) = c(CO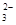 )+c(HCO
)+c(HCO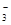 ) + c(H2CO3)
) + c(H2CO3)
电荷守恒:c(Na+) +c(H+)="2" c(CO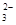 )+c(HCO
)+c(HCO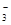 ) + c(H2CO3)
) + c(H2CO3)
合并两式可得:c(H+)+c(H2CO3)=c(OH-)+ c(CO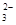 )
)
C:两者恰好中和生成弱酸强碱盐溶液,水解呈碱性:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D:两者溶液中自由移动的H+相同,但由于弱酸可继续电离出H+,故CH3COOH溶液消耗的碱液多
故答案为A
本题难度:一般
4、选择题 现有物质的量浓度均为 0.1 mol·L - 1 ?的下列五种物质的溶液:①HCl?②H2SO4?
③CH3COOH ?④NH4Cl ?⑤NaOH。下列有关说法正确的是:(?)
A.其溶液中由水电离出的c(H+)的大小关系是① = ②>③>④>⑤
B.其溶液中由水电离出的(H+)的大小关系是④>③>①= ⑤>②
C.上述溶液中能能促进水的电离是②>①=>⑤>③
D.上述溶液中能促进水的电离是只有④
参考答案:BD
本题解析:酸或碱都是抑制水的电离的,氢离子或OH-浓度越大,抑制程度越大。盐类水解是促进水电离的,所以其溶液中由水电离出的c(H+)的大小关系是④>③>①=⑤>②,因此答案是BD。
本题难度:简单
5、选择题 下列有关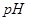 变化的判断中,错误的是
变化的判断中,错误的是
A.随着温度的升高,醋酸溶液的pH减小
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH减小
参考答案:B
本题解析:PH值是以H+为计算依据来进行计算的。
A正确,温度升高,对弱酸来讲,平衡朝电离方向进行,氢离子浓度增加,PH值减小。
B错误,升高温度,促进电离,纯水的PH减小。
C正确,氯水放在光照的条件下,一段时间后,HClO分解变成HCl,溶液酸性增强,PH减小。
D正确,氢氧化钠溶液久置于空气中变质,部分变成碳酸钠,碱性减弱,PH值减小。
本题难度:一般