1、计算题 (1) 常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH=?;写出该酸(HA)与NaOH溶液反应的离子方程式:?;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:?。
(2) 常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH?14-a(>、<、=)
(3) 向物质的量浓度均为0.01mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是?,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+)?。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:?
参考答案:(14分)
(1)①3 , HA+OH-=A-+H2O?(各2分)
②c(A-)>c(Na+)>c(H+)>c(OH-)? (2分)
(2)<? (2分)
(3)Mn2+,450?各2分)
(4)Ka·Kh=Kw? (2分)
本题解析:(1)①c(OH-)/c(H+)=1×10-8,c(OH-)×c(H+)=1×10-14,所以c(OH-)=10-11mol·L-1,则c(H+)=10-3mol·L-1,所以溶液的pH=3;氢离子浓度小于酸的浓度,所以该酸是弱酸,该酸(HA)与NaOH溶液反应的离子方程式为:HA+OH-═A-+H2O.
故答案为:3;HA+OH-═A-+H2O.
②pH=11的NaOH溶液中c(OH-)=10-3mol·L-1,HA是弱酸,酸的浓度远远大于氢离子浓度,所以pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中的溶质是酸和盐,溶液呈酸性,所以溶液中氢离子浓度大于氢氧根离子浓度,酸根离子浓度大于钠离子浓度,溶液中4种离子物质的量浓度大小关系是c(A-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(A-)>c(Na+)>c(H+)>c(OH-).
(2)假设氨水是强电解质时,pH=a的氨水中氢氧根离子浓度=10a-14mol·L-1,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则氢氧根离子浓度等于氢离子浓度,所以盐酸的pH=14-a;实际上氨水是弱碱,等体积的酸和碱混合后溶液呈中性,说明酸的浓度大于碱的浓度,则盐酸的pH<14-a,故选<.
(3)碳酸钡的溶度积常数等于碳酸锰的溶度积常数,所以锰离子先沉淀;当两种难溶电解质共存时,则
c(CO32-)=c(Mn2+)= ,溶液中c(Ba2+)=
,溶液中c(Ba2+)=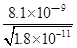 ,c(Ba2+):c(Mn2+)=
,c(Ba2+):c(Mn2+)=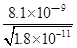 :
: ==450.
==450.
故答案为:Mn2+;450.
(4)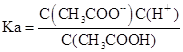 ,
, ,Kw=C(H+).C(OH-),所以Ka·Kh=Kw.
,Kw=C(H+).C(OH-),所以Ka·Kh=Kw.
故答案为:Ka·Kh=Kw.
本题难度:一般
2、选择题 某温度下,已知CH3COOH、HClO、H2CO3、H3PO4 电离平衡常数如下表所示,则0.1mol·L-1的下列各溶液pH最大的是(?)
表:几种弱酸的电离平衡常数
酸
| 电离常数
|
CH3COOH
| Ka=1.8×10-5
|
HClO
| Ka=3.0×10-8
|
H2CO3
| Ka1=4.3×10-7,Ka2=5.6×10-11
|
H3PO4
| Ka1=7.5×10-3,Ka2=6.2×10-8,Ka3=2.2×10-13
|
A.CH3COONa?B.NaClO?C.Na2CO3?D.Na3PO4
参考答案:D
本题解析:根据电离平衡常数可知,HPO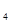
 的电离平衡常数最小,酸性最弱,所以其对应的强碱弱酸盐水解程度最大,碱性最强,故选D
的电离平衡常数最小,酸性最弱,所以其对应的强碱弱酸盐水解程度最大,碱性最强,故选D
本题难度:一般
3、选择题 在0.1 mo l · L-1的NH3·H2O溶液中,下列关系式正确的是(?).
A c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)
B c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C c(NH3·H2O)>c(NH4+)=c(OH-)>c(H+)?
D c(NH3·H2O)>c(NH4+)>c(H+)>c(OH-)
参考答案:A
本题解析:在NH3 ?H2O溶液中存在电离电离平衡:
NH3 ?H2O NH4++OH—和H2O
NH4++OH—和H2O H++OH-且NH3 ?H2O的电离程度很小,故 c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
H++OH-且NH3 ?H2O的电离程度很小,故 c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
本题难度:简单
4、选择题 某温度下,可逆反应HA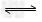 H++A-的电离常数为Ka,下列说法正确的是
H++A-的电离常数为Ka,下列说法正确的是
[? ]
A.Ka越大,表示该弱酸较易电离
B.Ka越大,表示该弱酸较难电离
C.Ka随反应物浓度的改变而改变
D.Ka随体系温度的改变而改变
参考答案:AD
本题解析:
本题难度:一般
5、填空题 在0.l mol·L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH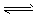 CH3COO-+H+,请根据该平衡完成下列表格,电离平衡移动方向填“正方向”或“逆方向”,离子浓度的变化请用“增大”、“减小”或“不变”表示。
CH3COO-+H+,请根据该平衡完成下列表格,电离平衡移动方向填“正方向”或“逆方向”,离子浓度的变化请用“增大”、“减小”或“不变”表示。

参考答案:
本题解析:
本题难度:一般