1、选择题 将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
[? ]
A. 
B. 
C. 
D. 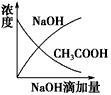
参考答案:D
本题解析:
本题难度:一般
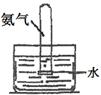
2、实验题 (16分)NH3在生活生产中用途广泛。
(1)下列关于NH3或氨水的实验能达到目的的是?(填编号)
编号
| A
| B
| C
| D
|
?
实验
装置
| 
| 
| 
| 
|
实验
目的
| 实验室模拟侯氏制碱法制备NH4HCO3
| 验证NH3易溶于水
| 制备银氨溶液
| 干燥NH3
|
(2)利用下图装置(气密性良好)在实验室模拟工业合成氨。
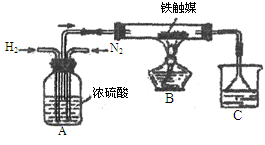
①N2和H2通过A装置,A装置的作用除了将气体混合外,还有?、?作用。
②实验结束,C中溶液有刺激性气味,C溶液中存在的含氮元素的微粒有?。
③某小组消耗大量的N2和H2,但得到的氨水浓度远低于其他组,可能的原因有?。(至少写出一项。注:实验试剂均未变质。)
(3)为验证氨水具有弱碱性,设计了下列实验,其中能达到实验目的是?。(填编号)
A.在氨水中滴入酚酞,溶液变红色?
B.测定相同浓度的NaOH和氨水溶液的pH
C.将氨水和过量AlCl3溶液混合,产生白色沉淀?
D.用pH试纸测定1mol/L NH4Cl溶液的酸碱性
(4)在实验室初步测定NH3?H2O的电离平衡常数。
①NH3?H2O电离平衡常数的表达式为:K=?。
②限选试剂和仪器:浓度为0.1mol/L 的氨水、0.1000mol/L 盐酸、1.000mol/L 盐酸、酚酞试剂、甲基橙试剂、蒸馏水、酸式滴定管、碱式滴定管、锥形瓶、胶头滴管、pH计、烧杯等(省略夹持仪器)
实验步骤
| 实验目的
|
步骤1:
①用碱式滴定管取20.00ml 0.1mol/L 的氨水于锥形瓶中,加入几滴?。
②?。
③?,停止滴定,记录数据。重复测定2-3次。
| ?
测定氨水的准确浓度。
|
步骤2:?
?;
| ?;
|
步骤3:通过计算得出氨水的电离常数。
参考答案:
(1)B (2分)
(2)①观测气体流速、干燥气体?(2分)
②NH4+? NH3·H2O? NH3?(2分)
③氢气与氮气的流速过快而来不及反应、温度过高或过低条件,催化剂的催化效果不理想、所全的接触面过小?(2分)
(3)BD?(2分)
(4)①K=c(NH4+)· c(OH-)/c(NH3·H2O)?(2分)
步骤1:
①甲基橙试液。②用酸式滴定管取0.1000mol/L 盐酸,并进行滴定。(1分)
③当锥形中的溶液由黄色变为橙色,且保持半分钟不褪色,停止滴定,记录数据,重复2-3次?(1分)
步骤2:用PH计测出氨水的PH值?(1分)?
通过测出的PH值计算得出c(OH-)?(1分)
本题解析:(1)A.侯氏制碱法中,因为二氧化碳的溶解度小,氨气的溶解度大,应先通能入氨气,再通入过量的二氧化碳才能生成较多的碳酸氢铵
C.制备银氨溶液,应是在硝酸银溶液中滴加稀氨水,至产生的沉淀恰好溶解为止
D.无水硫酸铜用于检验水的存在而不用于干燥
(2)①从“浓硫酸”去理解和气泡的快慢观测气体的流速
②由NH3 + H2O ≒NH3·H2O? NH3·H2O ≒ NH4+ + OH-可知
③主要从气的流速、催化剂的催化效果、反应的接触面等角度去答题
(3)抓住弱电解质的部分电离或相应的盐溶液的酸碱性
(4)①电离平衡常数的测定关键在于测出PH值计算出c(OH-),通过滴定法测定c(NH3·H2O)。
本题难度:一般
3、选择题 用pH均为2的盐酸和醋酸溶液,分别中和等体积.等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
[? ]
A.V1>V2
B.V1<V2
C.V1=V2
D.V1≤V2
参考答案:A
本题解析:
本题难度:一般
4、选择题 常温下,0.1mol/L的氨水pH=11,下列叙述错误的是
A.向该溶液中加水稀释:c(OH—)/c(NH3·H2O )增大
B.0.lmol/L氨水与0.lmol/LH2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=2c(SO42—)+c(OH—)
C.0.1mol/L氨水与0.05mol/LHCl溶液等体积混合后所得溶液中:c(NH4+)+n(NH3)+n(NH3·H2O)=2n(Cl—)
D.浓度均为0.1mol/L氨水和NH4Cl溶液等体积混合后,若溶液呈碱性,则
|
c(NH3·H2O)>c(Cl—)>c(NH+)>c(OH—)>c(H+)
参考答案:D
本题解析:在氨水中存在平衡:NH3·H2O NH4++OH-,向该溶液中加水稀释:c(OH—)减小, c(NH3·H2O )也减小,但是由于平衡正向移动,所以c(NH3·H2O )减小的倍数大于c(OH—)减小的倍数,所以c(OH—)/c(NH3·H2O )增大。正确。B.0.lmol/L氨水与0.lmol/LH2SO4溶液等体积混合后所得溶液,根据电荷守恒可得:c(NH4+)+c(H+)=2c(SO42—)+c(OH—)。正确。C.0.1mol/L氨水与0.05mol/LHCl溶液等体积混合后所得溶液,根据物料守恒可得:n(NH4+)+n(NH3)+n(NH3·H2O)=2n(Cl—)。正确。D.浓度均为0.1mol/L氨水和NH4Cl溶液等体积混合后,若溶液呈碱性,则NH3·H2O的电离作用大于NH4+的水解作用,c(NH4+)>c(Cl—)>c(NH3·H2O)>c(OH—)>c(H+)。错误。
NH4++OH-,向该溶液中加水稀释:c(OH—)减小, c(NH3·H2O )也减小,但是由于平衡正向移动,所以c(NH3·H2O )减小的倍数大于c(OH—)减小的倍数,所以c(OH—)/c(NH3·H2O )增大。正确。B.0.lmol/L氨水与0.lmol/LH2SO4溶液等体积混合后所得溶液,根据电荷守恒可得:c(NH4+)+c(H+)=2c(SO42—)+c(OH—)。正确。C.0.1mol/L氨水与0.05mol/LHCl溶液等体积混合后所得溶液,根据物料守恒可得:n(NH4+)+n(NH3)+n(NH3·H2O)=2n(Cl—)。正确。D.浓度均为0.1mol/L氨水和NH4Cl溶液等体积混合后,若溶液呈碱性,则NH3·H2O的电离作用大于NH4+的水解作用,c(NH4+)>c(Cl—)>c(NH3·H2O)>c(OH—)>c(H+)。错误。
本题难度:一般
5、选择题 在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是
[? ]
A.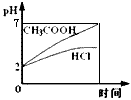
B.
C.
D.
参考答案:B
本题解析:
本题难度:一般