1、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中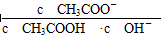 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
参考答案:B
本题解析:本题考查弱电解质的电离平衡,意在考查考生对电离平衡的理解和应用能力。醋酸溶液加水稀释后,CH3COOH的电离程度增大,n(H+)、n(CH3COO-)增大,A项错误;根据CH3COOH的电离平衡常数Ka=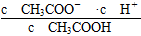 =
= ,则
,则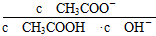 =
=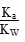 ,由于温度不变,Ka、KW均不变,因此
,由于温度不变,Ka、KW均不变,因此 不变,B项正确;醋酸加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,C项错误;再加入10 mL pH=11的NaOH溶液,反应后得到CH3COOH和CH3COONa的混合溶液,溶液显酸性,pH<7,D项错误。
不变,B项正确;醋酸加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,C项错误;再加入10 mL pH=11的NaOH溶液,反应后得到CH3COOH和CH3COONa的混合溶液,溶液显酸性,pH<7,D项错误。
本题难度:一般
2、选择题 已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH CH3COO— + H+?K1=1.75×10-5?△H1>0
CH3COO— + H+?K1=1.75×10-5?△H1>0
CH3COO— + H2O CH3COOH + OH—?K2=5.71×10-10?△H2>0
CH3COOH + OH—?K2=5.71×10-10?△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是
A.对混合溶液进行微热,K1增大、K2减小
B.混合溶液的pH<7
C.混合溶液中c(CH3COO—)>c(Na+)
D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO—)减小
参考答案:BC
本题解析:A、电离和水解均是吸热的,所以对混合溶液进行微热,K1、K2均增大,A不正确;B、由于醋酸根的水解常数小于醋酸的电离常数,因此二者浓度相同的混合液显酸性,即pH<7,B正确;C、醋酸的电离程度大于醋酸根的水解程度,溶液显酸性,则根据电荷守恒混合溶液中c(CH3COO—)+c(OH—)=c(Na+)+c(H+)可知,混合溶液中c(CH3COO—)>c(Na+),C正确;D、温度不变,若在混合溶液中加入少量NaOH固体,中和氢离子,促进醋酸的电离,所以溶液中c(CH3COO—)增大,D不正确,答案选BC。
本题难度:一般
3、填空题 某化学兴趣小组研究草酸(乙二酸,HOOC-COOH)的性质,他们查找了相关数据。
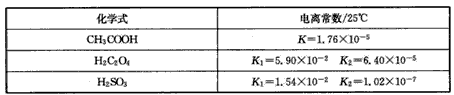
(1)0.1mol/L的CH3COOH、H2C2O4、H2SO3溶液pH最小的是____,最大的是___。
(2)KHSO3的溶液呈酸性,表明HSO3-的电离___水解(填“强于”、“弱手”或“等于”)。
(3)0.1mol/L的H2C2O4溶液与0.1mol/L NaOH溶液等体积混合,溶液的pH=a(溶液的体积等于混合前体积和)。
①则a___7(选填“>”、“<”、“=”或“不确定”);
②c(HC2O4-)+2c(C2O42-)=___(用含a的代数式表示)。
参考答案:(1)H2C2O4 ;CH3COOH
(2)强于
(3)①< ;②0.05+10-a-10-14+a
本题解析:
本题难度:一般
4、选择题 某二元酸H2A在水中发生电离:H2A=H++HA-,HA- H++A2-。下列叙述中不正确的是
H++A2-。下列叙述中不正确的是
A.在NaHA溶液中c(Na+)>c (HA-)> c(H+) >c (OH-)
B.在Na2A溶液中c (Na+)="2c" (A2-)+2c(HA-)+2c (H2A)
C.在Na2A溶液中c (OH-) ="c" (HA-)+ c (H+)
D.在H2A溶液中c (H+)="c" (HA-)+2c (A2-)+c (OH-)
参考答案:B
本题解析:根据题给信息知H2A 第一步完全电离,第二步部分电离,故HA-不发生水解,A2-发生水解只生成HA-。A、在NaHA溶液中存在:HA- H++A2-、H2OA-
H++A2-、H2OA- H++OH-,故c(Na+)>c (HA-)> c(H+) >c (OH-),正确;B、在Na2A溶液中A2-发生水解只生成HA-,物料守恒式为c (Na+)="2c" (A2-)+2c(HA-),错误;C、根据质子守恒知在Na2A溶液中c (OH-) ="c" (HA-)+ c (H+),正确;D、根据电荷守恒知在H2A溶液中c (H+)="c" (HA-)+2c (A2-)+c (OH-),正确。
H++OH-,故c(Na+)>c (HA-)> c(H+) >c (OH-),正确;B、在Na2A溶液中A2-发生水解只生成HA-,物料守恒式为c (Na+)="2c" (A2-)+2c(HA-),错误;C、根据质子守恒知在Na2A溶液中c (OH-) ="c" (HA-)+ c (H+),正确;D、根据电荷守恒知在H2A溶液中c (H+)="c" (HA-)+2c (A2-)+c (OH-),正确。
考点:考查盐类水解原理的应用,涉及离子浓度大小比较和三个守恒式的应用。
本题难度:一般
5、选择题 对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.c(H+)=c(CHCOO-)+c(OH-)
B.加入少量CH3COONa固体后,加入,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性
参考答案:B
本题解析:根据电荷守恒,A正确;加入少量CH3COONa固体后,平衡虽向逆向移动,但CH3COO-不能完全抵消,c(CH3COO-)增大了,B错;由于pH=3,溶液中c(H+)=10-3mol/L,根据水的离子委积常数知,由水电离出的c(H+)是1.0×10-11 mol/L,C正确;pH醋酸+pH氢氧化钠=14,且等体积混合,反应后醋酸过量显酸性,D正确。答案选B。
本题难度:一般