1、填空题 某化学兴趣小组从实验室中获取5种实验药品A、B、C、D、E,它们均由下表中的离子构成。

为了鉴别上述化合物,分别完成以下实验:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B_________D__________。
(2)将含1 mol A的溶液与含1 mol E的溶液混合,所得溶液中所有离子的浓度由大到小的顺序是_______________________。
(3)写出实验②发生反应的离子方程式___________________。
(4)向含1mol C的溶液中滴加1000 mL 2 mol/L Ba(OH)2溶液,充分反应后溶液pH______7(填“大 于”、“小于”或“等于”),用离子方程式解释其原因_____________________。
2、简答题 (NH4)2Fe(SO4)2比FeSO4稳定,其标准溶液是定量实验中的常用试剂.
(1)实验室用(NH4)2Fe(SO4)2固体配制一定浓度的(NH4)2Fe(SO4)2标准溶液.
①配制溶液时,需要使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要如图中的______(填字母代号)
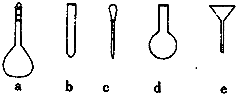
②若要配制0.100mol?L-1的(NH4)2Fe(SO4)2标准溶液250ml,需称取(NH4)2Fe(SO4)2______g
③若在配制过程中,烧杯中的(NH4)2Fe(SO4)2溶液有少量溅出,则所得溶液浓度______;若在定容时,俯视液面,则所得溶液浓度______.(填“偏高”、“偏低”、“无影响”)
(2)能电离出两种阳离子的盐称为复盐,下列物质中属于复盐的有______.
a.KAl(SO4)2?b.KAlO2?c.NH4Al(SO4)2?d.[Ag(NH3)2]NO3
(3)(NH4)2Fe(SO4)2溶液呈______性,试用离子方程式解释其原因:______;______.
3、填空题 请回答下列问题.
(1)碳酸钠俗称为______,其水溶液显______性(填“酸”、“碱”或“中性”).
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,其反应的离子方程式为______.
等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者______后者(填“>”、“<”或“=”)
(3)久置的硅酸钠溶液会出现浑浊现象其原因为______(用化学方程式表示).
4、选择题 实验测得常温下0.1mol/L某一元酸(HA)溶液的pH不等于l,0.1mol/L某一元碱(BOH)溶液里:c(H+)/c(OH-)=10-12.将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )
A.c(B+)>c(A-)>c(OH-)>c(H+)
B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(H+)>c(A-)>c(OH-)>c(B+)
D.c(B+)>c(A-)>c(H+)>c(OH-)
5、选择题 下列有关溶液中粒子浓度的关系式中,正确的是?
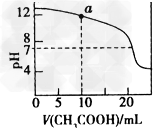
用0.1?mol/L?CH2COOH溶液滴定 20?mL0.1?moI/L?NaOH溶液的滴定曲线
[? ]
A.将等体积的pH分别为3和4的醋酸溶液完全中和时消耗氢氧化钠的物质的量,前者是后者的10倍 ?
B.若H2A是二元弱酸,则0.1?mol·L-1 NaHA溶液中:c(Na+)?=2c(A2- )+c(HA-)+c(H2A) ?
C.CH3COOH溶液与NaOH溶液恰好中和时,溶液中c(Na+)=c(CH3COO-)>c(OH-)=c(H+) ?
D.如图曲线上a点对应的溶液中各离子浓度的关系:c(OH-)=c(H+)+c(CH3COO-)+ 2c(CH3COOH)?