1、选择题 下列两种物质混合后不能发生离子反应的是( )
A.硝酸溶液和碳酸钠溶液混合
B.氯化钠溶液和硝酸银溶液混合
C.硫酸钾溶液和氯化钡溶液混合
D.硝酸钾溶液和氯化钡溶液混合
参考答案:A、硝酸溶液中的氢离子和碳酸钠溶液中的碳酸根离子反应生成水和二氧化碳,故A错误;
B、氯离子和银离子反应会生成氯化银沉淀,故B错误;
C、硫酸根和钡离子反应会生成硫酸钡沉淀,故C错误;
D、硝酸钾溶液和氯化钡溶液混合后不会发生反应,故D正确.
故选D.
本题解析:
本题难度:简单
2、选择题 可溶性化合物A、B、C由下表中离子组合而成(每种离子只存在于一种化合物中)。
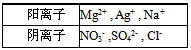
现将等物质的量的A、B、C一起溶于水后,所得混合溶液中除H+、OH-外还含有五种离子。则A的化学式不可能是
[? ]
A. AgNO3
B. Na2SO4
C. MgCl2
D. MgSO4
参考答案:D
本题解析:
本题难度:简单
3、填空题 目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是?。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Ⅱ Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:

①写出反应①的离子方程式?。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)?Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是?。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是?。
(4)FeO42—在水溶液中的存在形态图如图所示。
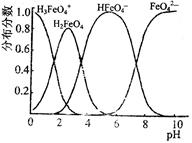
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是?。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,?转化为?(填化学式)。
参考答案:
(1)Zn(1分);
(2)①Cl2+2OH—=Cl—+ClO—+H2O(2分)②<(2分);
(3)杀菌消毒(1分),净化(1分);
(4)①先变大,后变小(2分)②HFeO4-转化为FeO42—(2分)。
本题解析:
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,根据电池的形成条件,其中高铁酸钾为正极材料得电子;负极失电子的是锌,故电池负极材料是Zn;
(2)①分析反应①是将氯气通入到氢氧化钠溶液中,其离子方程式为:Cl2+2OH—=Cl—+ClO—+H2O;②反应③是:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH,其能在某低温下进行的,说明此温度下Ksp(K2FeO4)<Ksp(Na2FeO4);
(3)由于K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,故K2FeO4在水处理中起到了杀菌消毒的作用;生成的胶状氢氧化铁还有净化作用;
4Fe(OH)3↓+8OH—+3O2↑,故K2FeO4在水处理中起到了杀菌消毒的作用;生成的胶状氢氧化铁还有净化作用;
(4)①分析FeO42—在水溶液中的存在形态图,可知在pH由10变化到2时,HFeO4-的分布分数是先变大,后变小;②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中HFeO4-转化为FeO42—。
本题难度:困难
4、选择题 根据下表提供的数据可知能大量共存的微粒组是
A.H2CO3、HCO3-、CH3COO-、ClO-
B.HClO、 HCO3-、CH3COO-、ClO-
C.HClO 、HCO3-、ClO-、CO32-
D.HCO3-、CH3COO-、ClO-、CO32-
参考答案:BD
本题解析:试题分析:A、根据表中数据可知,碳酸的酸性强于次氯酸的,所以H2CO3与ClO-不能大量共存,A不正确;B、同样分析,酸性强弱顺序是CH3COOH>H2CO3>HClO>HCO3-,所以B中微粒可以大量共存;C、酸性是HClO>HCO3-,所以HClO与CO32-不能大量共存,C不正确;D、同理可知选项D中微粒可以大量共存,D正确,答案选BD。
考点:考查电离平衡常数的应用、离子共存等
本题难度:简单
5、实验题 (12分)某无色溶液中含有K+、SO32-、SO42-、Cl、OH-,检验溶液中除OH-外其他阴离子的步骤如下图所示。

回答下列问题:
(1)填写试剂的化学式①?②?⑤?。
(2)试剂④可能是??(填选项字母)。
A.石蕊试液
B.硫酸铜溶液
C.溴水
D.品红溶液