1、填空题 (10分)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
元素
| 25Mn
| 26Fe
|
电离能/kJ·mol-1
| I1
| 717
| 759
|
I2
| 1509
| 1561
|
I3
| 3248
| 2957
|
?回答下列问题:
(1)Mn元素外围电子层的电子排布式为?,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是?。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是?。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 ?晶体。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为?。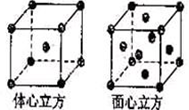
2、选择题 超铀元素 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子 的中子数与核外电子数之差为
的中子数与核外电子数之差为
A.0
B.118
C.57
D.175
3、选择题 下列说法正确的是(?)
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
4、填空题 (10分)下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
元素
| 有关信息
|
A
| 元素主要化合价为 —2,原子半径为0 .074 n m? .074 n m?
|
B
| 所在主族序数与所在周期序数之差为4
|
C
| 原子半径为0.102 n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰
|
D
| 最高价氧化物的水化物,能按1∶1电离出电子数相等的阴、阳离子
|
E
| 原子半径为0.075 n m,最高价氧化物的水化物与其氢化物组成一种盐X
|
(1)画出B的离子结构示意图?;写出D元素最高价氧化物的水化物电子式?。
(2)盐X水溶液显?(填“酸”“碱”“中”)性,用离子方程式解释其原因?;(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为?;
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。该燃料电池放电时,正极的电极反应式是?。
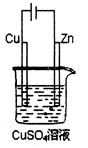
(5)如上图是一个电解过程示意图。假设使用Y-空气燃料电池作为本过程的
电源,铜片质量变 化128g,则Y一空气燃料电池理论上消耗标准状况下的空
化128g,则Y一空气燃料电池理论上消耗标准状况下的空
气(设空气中氧气的体积含量为20%)?L。
5、选择题 下列说法不正确的是
A.对于Na2SO4,从组成上看,既属于钠盐,又属于硫酸盐
B.对于Na2SO4和Na2S,从组成上看,都可以看作钠盐,又可以看作硫酸盐
C.每一种元素都可以在一定条件下以单质或化合物的形态存在
D.血糖属于混合物