1、选择题 上海世博园地区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟的困扰.你估计这一空气污染物是因为含有( )
A.FeO粉尘
B.Fe2O3粉尘
C.Fe粉尘
D.碳粉
参考答案:B
本题解析:
本题难度:简单
2、填空题 某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
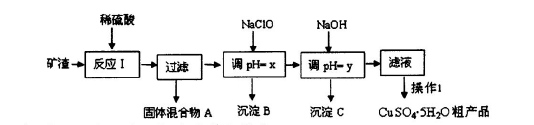
已知: ①Cu2O +2 H+="Cu" + Cu2++H2O
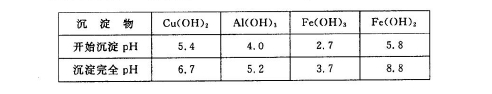
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)为了加快反应I的速率,可以采取的措施是??(写2点)。
(2)固体混合物A中的成分是?。
(3)反应I完成后,铁元素的存在形式为?(填离子符号);写出生成该离子的离子方程式??。
(4)操作1主要包括:?、?、?。洗涤CuSO4?5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是??。
(5)用惰性电极电解胆矾溶液一段时间,加人0.1 mol的Cu(OH)2可恢复溶液原况(浓度、成分),则电解时转移电子的物质的量为?.。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 ?。
参考答案:(1)适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等;
(2)SiO2、Cu?
(3)Fe3+? 2Fe3++Cu=Cu2++2Fe2+
(4)蒸发浓缩、冷却结晶、过滤;冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失;
(5)0.4mol
(6)2Fe2++7ClO-+2H++5H2O=2Fe(OH)3+Cl-+6HClO
本题解析:(1)由于矿渣为固体,所以为了加快反应I的速率,可以采取的措施是浆固体粉碎。也可以适当升高反应的温度;或增大反应物H2SO4的浓度等措施。(2)SiO2是酸性氧化物,不能与酸发生反应;其它金属氧化物Cu2O、Al2O3、Fe2O3与硫酸发生反应:Cu2O+H2SO4=Cu+CuSO4+H2O;Al2O3+3H2SO4= Al2(SO4)3+3H2O;Fe2O3+3H2SO4= Fe2(SO4)3+3H2O; Fe2(SO4)3+Cu= CuSO4+ 2FeSO4。因此发生反应I后过滤出的固体混合物A中的成分是SiO2、Cu。(3)因为在矿渣中Fe元素的化合价为+3价,先发生复分解反应,得到Fe2(SO4)3,然后发生反应:2Fe3++Cu=Cu2++2Fe2+。因此该完成后,铁元素的存在形式为+2价的Fe。即Fe2+。(4)从硫酸铜溶液中制取硫酸铜晶体的操作1主要包括: 蒸发浓缩、冷却结晶、过滤。洗涤CuSO4?5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是CuSO4溶液溶解于水,而且温度越高,溶解度越大。若用冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失;(5)用惰性电极电解胆矾溶液电解反应方程式为:2CuSO4+2H2O 2Cu+O2↑+2H2SO4.若加入0.1 mol的Cu(OH)2会发生反应:Cu(OH)2+H2SO4= CuSO4+2H2O 。产生0.1mol的CuSO4和0.2mol的水恢复原来的溶液。则根据电解方程式中的物质间的关系可知电子转移0.4mol。(6)NaClO有氧化性,Fe2+有还原性。所以用NaClO调节pH,生成沉淀B为Fe(OH)3,同时生成一种具有漂白作用的物质为HClO,该反应的离子方程式为2Fe2++7ClO-+2H++5H2O=2Fe(OH)3↓+Cl-+6HClO
2Cu+O2↑+2H2SO4.若加入0.1 mol的Cu(OH)2会发生反应:Cu(OH)2+H2SO4= CuSO4+2H2O 。产生0.1mol的CuSO4和0.2mol的水恢复原来的溶液。则根据电解方程式中的物质间的关系可知电子转移0.4mol。(6)NaClO有氧化性,Fe2+有还原性。所以用NaClO调节pH,生成沉淀B为Fe(OH)3,同时生成一种具有漂白作用的物质为HClO,该反应的离子方程式为2Fe2++7ClO-+2H++5H2O=2Fe(OH)3↓+Cl-+6HClO
本题难度:困难
3、填空题 (6分)钠、铝和铁是三种重要的金属。请回答:
(1)三种金属中,____既能与盐酸又能与氢氧化钠溶液反应,且生成物均为盐和氢气。写出该物质与氢氧化钠溶液反应的化学方程式__________________________________
(2)三种金属在一定条件下均能与水发生反应。其中,铁与水蒸气反应的化学方程式为_______________________________。
钠与水反应时可观察到的实验现象有__________(填序号)。在实验室中,通常将金属钠保存在?中;钠与水反应的化学方程式为___________________________
a. 钠沉入水底?b.钠熔成小球? c. 钠四处游动? d.溶液变为红色
参考答案:(1)铝(Al)?2Al+2NaOH+ 2H2O = 2NaAlO2 + 3H2↑
(2)3Fe+4H2O(g)= Fe3O4+4H2?b c?2Na+2H2O===2NaOH?+H2↑
本题解析:(1)铝既能与盐酸又能与氢氧化钠溶液反应,且生成物均为盐和氢气;钠与盐酸反应生成物均为盐和氢气,而与氢氧化钠溶液反应,生成物均为碱和氢气;铁与盐酸反应生成物均为盐和氢气,而不与碱反应。
(2)铁与水蒸气反应生成黑色的磁性氧化铁,即四氧化三铁(Fe3O4),还有氢气,方程式为:3Fe+4H2O(g)= Fe3O4+4H2。钠的密度比水小且熔点较低,钠与水反应是放热反应,因此现象为:附在水面上,因有氢气生成,所以钠四处游动,还熔化成小球,如水中滴加酚酞,因有碱生成,所以溶液会变红色。金属钠是非常活泼的金属,所以把钠密闭保存在煤油中,煤油的密度小于钠的密度,所以钠沉到煤油的底部,隔绝空气和水蒸气。钠与水反应方程式为:2Na+2H2O===2NaOH?+H2↑。
点评:本题主要考查了常见金属的有关性质知识,完成此题,要熟记和理解金属的性质及用途、常见金属的特性及其应用等相关知识,进行选择或解答即可。
本题难度:一般
4、选择题 某工厂的废渣中混有少量的锌粉和氧化铜(其他成分不跟酸反应),跟大量废盐酸接触形成污水,产生公害.若向污水中撒入铁粉且反应后铁粉有剩余,此时污水中一定含有的金属离子是( )
A.Fe2+、Cu2+
B.Cu2+、H+
C.Zn2+、Fe2+
D.Zn2+、H+
参考答案:当少量的氧化铜和锌粉混合后氧化铜与锌都可以与盐酸反应生成氯化锌和氯化铜,且因为铁的活动性比铜强所以可以置换出氯化铜溶液中的铜而生成氯化亚铁,且由于铁粉过量,所以溶液中一定不会存在氯化铜,由于铁的活动性比锌弱所以不会置换出氯化锌溶液中的锌,所以溶液中一定含有的溶质是ZnCl2、FeCl2,
因此溶液中含有的金属离子是Zn2+、Fe2+;
故选C.
本题解析:
本题难度:简单
5、选择题 某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属不溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
参考答案:D
本题解析:A不正确,溶液中含有NO3-,加入硫酸,可以继续氧化金属。B不一定正确,也可能是亚铁离子。336mlNO是0.015mol,所以0.05b>0.015mol,C不正确。合金中铁和铜的物质的量分别是ymol-aymol、aymol,失去电子是3ymol-3aymol+2aymol=3ymol-aymol。则被还原的硝酸是ymol-ay/3mol。所以一定有0.05b≥y-ay/3+3y-3ay+2ay,解得b≥80 y (1—a/3),答案选D。
本题难度:一般