1、填空题 (1)铜是人类最早使用的金属之一,以下是冶炼铜的一个反应:
Cu2S+2Cu2O 6Cu+SO2
6Cu+SO2
该反应中被氧化的元素是?,若反应中转移1mol电子,得到Cu?mol。?
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:?
?。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法?(填“正确”或“不正确”),原因是?
?。
2、选择题 下列有关金属元素及其化合物说法不正确的是
A.铁和氯气反应生成三价铁,和盐酸反应生成亚铁离子
B.铜在潮湿的空气中易生锈呈绿色,锈的主要成分是碱式碳酸铜
C.过氧化钠和氧化钠均可以与水、二氧化碳反应,但生成的产物不完全相同
D.等质量的铝分别与足量的酸和碱溶液反应,生成气体的体积一定相同
3、简答题 工业上用铝土矿(主要成分是A1203,还有少量的Fe203,SiO2)提取冶炼铝的原料氧化铝.工艺流程图如图:
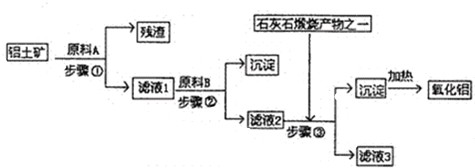
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______.步骤②反应的离子方程式是:______.
(3)步骤③的离子化学方程式是:______.
(4)步骤①②③的操作都是______(填操作名称),要检验Al(OH)?3沉淀是否完全的方法是______.
(5)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?______.
4、填空题 (10分)向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)―→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段:?。
第二阶段:?。
(2)正确表达这两个阶段反应中,加入铁粉的物质的量与溶液中铁元素存在的形式的关系
?
?
?。
(3)在图中画出溶液中Fe2+、Fe3+、NO的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
5、选择题 下列有关金属及其化合物的说法正确的是?
[? ]
A.由于锅在常温下不能与氧气反应,所以铝制品具有一定的抗腐蚀性能,是一种应用广泛的金属材料
B.往FeCl3溶液中滴入淀粉KI溶液,溶液变蓝色
C.向紫色石蕊试液中加入过量的Na2O2粉末,振荡,溶液变为蓝色并有气泡产生
D.装修门窗使用的铝合金材料的硬度比铝小,熔点比铝低