1、填空题 (10分)已知Fe(s)+CO2(g) FeO(s)+CO(g) K1…①
FeO(s)+CO(g) K1…①
Fe(s)+H2O(g) FeO(s)+H2(g) K2…②
FeO(s)+H2(g) K2…②
H2(g)+CO2(g) H2O(g)+CO(g) K3…③
H2O(g)+CO(g) K3…③
又已知不同温度下,K1、K2值如下:
温度℃
| K1
| K2
|
500
| 1.00
| 3.15
|
700
| 1.47
| 2.26
|
900
| 2.50
| 2.00
|
温度℃
| K1
| K2
|
500
| 1.00
| 3.15
|
700
| 1.47
| 2.26
|
900
| 2.50
| 2.00
|

(1)若500℃时进行反应①,CO2起始浓度为1.6 mol·L-1, 4分钟后建立平衡,用CO表示的反应速率为 。
(2)900℃ 进行反应③,其平衡常数K3为 (求具体数值),焓变ΔH 0(填“>”、“=”或“<”),若已知该反应仅在高温时正反应自发,则ΔS 0(填“>”、“=”或“<”)。
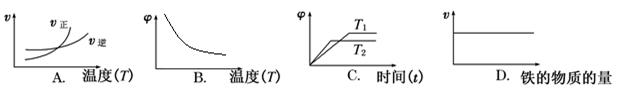
(3)下列图像符合反应②的是 (填序号)(图中v是速率,φ为混合物中H2的体积百分含量)。
2、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表
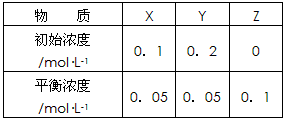
下列说法错误的是
[? ]
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变压强可以改变此反应的平衡常数
3、选择题 在一固定容积的容闭容器中,加入2 L X 和3 L Y 气体,发生如下反应:
n X(g) + 3Y(g)  2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,
2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,
则化学方程式中的n 值为
A.1
B.2
C.3
D.4
4、选择题 对可逆反应4NH3(g)+ 5O2(g)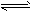 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
[? ]
A.达到化学平衡时,4v正(O2)= 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)= 3v正(H2O)
5、填空题 (19分)我国《车用燃料甲醇国家标准》的实施拉开了车用燃料低碳革命的大幕,一些省市正在陆续试点与推广使用甲醇汽油。甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)  CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。

请根据图示回答下列问题:
(1)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=_______________。
(2)图Ⅱ表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,在图Ⅱ中画出使用催化剂后的能量变化曲线b。
(3)写出该反应的热化学方程式 。
(4)该反应的平衡常数K的表达式为 ;当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(5)恒容条件下,下列措施中能使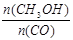 增大的有 。
增大的有 。
A.升高温度 B.充人He气
C.再充入1molCO和2molH2 D.使用催化剂
(6)在恒温条件下,保持CO浓度不变,扩大容器体积,则平衡 (填“逆向移动”、“正向移动”、“不移动”)
(7)在温度、容积相同的三个密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下
容器
| 甲
| 乙
| 丙
|
投料量
| 1mol CO 、2mol H2
| 1molCH3OH
| 2molCH3OH
|
CH3OH的浓度(mol·L-1)
| c1
| c2
| c3
|
反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 吸收Q3kJ
|
体系压强(Pa)
| P1
| P2
| P3
|
反应物转化率
| α1
| α2
| α3
|
则下列关系正确的是
A.c1= c2 B.Q3= 2Q2 C.2 P1<P3
D.α1+α2=1 E.2α2=α3
E.2α2=α3
F.该反应若生成1molCH3OH放出的热量为(Q1+ Q2)kJ
(8)若在一体积可变的密闭容器中充入1mol CO、2mol H2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动,理由是