1、选择题 在电解水制取H2和O2时,为了增强溶液的导电性,常加入一些电解质。下列物质中最合适的是
A.Na2SO4
B.CuC12
C.NaCl
D.AgNO3
参考答案:A
本题解析:A 正确,电解Na2SO4,相当于电解水,能增强溶液的导电性
B 错误,会有铜析出
C 错误,会有氯气放出
D 错误,会有银析出
本题难度:一般
2、选择题 已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中
c(H+)/c(CH3COOH)值增大,可以采取的措施是
[? ]
A.加少量烧碱溶液
B.升高温度
C.加少量冰醋酸
D.加水
参考答案:BD
本题解析:
本题难度:一般
3、选择题 从下列事实所得出的相应结论正确的是
[? ]
实 验 事 实
结?论?
A.
Cl2的水溶液可以导电
Cl2是电解质
B.
将燃烧的镁条放入CO2中能继续燃烧
还原性:Mg>C
C.
将Na2CO3溶液与苯酚浊液混合溶液变澄清
酸性:苯酚>HCO3-
D.
常温下白磷可自燃而氮气须在放电时才与氧气反应
非金属性:P>N
参考答案:B
本题解析:
本题难度:一般
4、简答题 某化学兴趣小组的同学通过实验比较等体积(200mL)0.55mol/L硫酸、1.1mol/L盐酸、1.1mol/L醋酸分别与过量金属反应生成氢气的速率请你协助完成如下实验,并回答相关问题.
(1)实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由).选择的金属是______,不选其它两种金属的理由是______.
(2)实验原理:(用离子方程式表示)______.
(3)甲同学设计的实验装置,乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进.你认为乙同学改进的措施是:______.
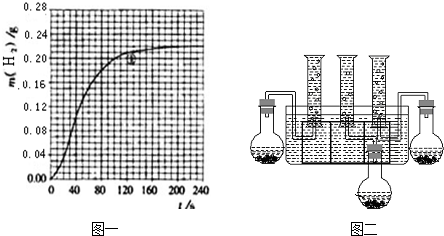
(4)按改进后的装置进行实验,实验中HCl与金属反应产生H2质量随时间变化的关系见图一,计算实验在80-120s范围内HCl的平均反应速率______(忽略溶液体积变化,写出计算过程).
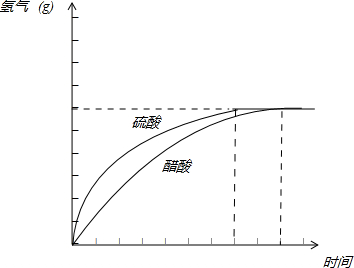
(5)请在答题卡的框图中,画出HAc、H2SO4与金属反应产生H2质量随时间变化关系的预期结果示意图.
(6)量筒的规格由______决定.
(7)对盐酸和醋酸反应图象的异同,你的解释是______.
参考答案:(1)Na太活泼,能和水反应产生氢气,影响实验结论;Fe与酸反应的速率较慢,实验时间较长.故镁较合适,
故答案为:Mg;由于Na太活泼,能和水反应产生氢气,影响实验结论;Fe与酸反应的速率较慢,实验时间较长;
(2)镁与硫酸、盐酸反应实质为,镁与氢离子反应,置换出氢气,反应离子方程式为2H++Mg=H2↑+Mg2+,
醋酸是弱电解质,应写化学式,离子方程式为?2CH3COOH+Mg=H2↑+Mg2++2CH3COO-,
故答案为:2H++Mg=H2↑+Mg2+、2CH3COOH+Mg=H2↑+Mg2++2CH3COO-;
(3)保证同时向三烧瓶内加入酸,可同时用分液漏斗分别向烧瓶中加入酸液,故答案为:同时用分液漏斗分别向烧瓶中加入酸液;
(4)由图可知,80-120s范围内生成氢气的质量为0.21g-0.18g=0.03g,
?2HCl~H2 ↑?
2mol? 2g
nmol? 0.03g
所以n=0.03mol
所以△c(HCl?)=0.03mol0.2L=0.15mol/L,
所以v(HCl?)=0.15mol/L40s=0.00375mol/(L.min),
故答案为:0.00375mol/(L.min);
(5)硫酸中氢离子浓度大于醋酸中氢离子浓度,反应速率硫酸比醋酸快,两种提供的氢离子的物质的量相等,最后生成的氢气一样多.HAc、H2SO4与金属反应产生H2质量随时间变化关系的示意图为:
,故答案为:

;
(6)量筒用于测量生成氢气的体积,氢气的体积取决于酸溶液的体积,故答案为:酸溶液的体积;
(7)醋酸中存在电离平衡,反应开始时c(H+)小于盐酸,故反应速率也小于盐酸.由于醋酸、盐酸最终提供的H+的物质的量相等,故最后的得到H2体积相等,
故答案为:醋酸中存在电离平衡,反应开始时c(H+)小于盐酸,故反应速率也小于盐酸.由于醋酸、盐酸最终提供的H+的物质的量相等,故最后的得到H2体积相等.
本题解析:
本题难度:一般
5、填空题 (3分)在滴有酚酞的氨水中加入NH4Cl溶液后红色变浅,解释:______。
参考答案:
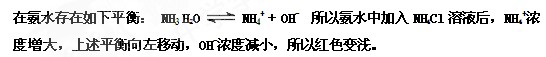
本题解析:略
本题难度:简单