1、实验题 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
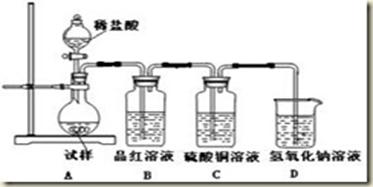
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为________________;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为__________;此时在B、C两装置中可能观察到的现象为___________或___________。
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)为___________。检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取____________措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是______(填“甲”或“乙”)。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式____________。
参考答案:(1)先逐渐增大,后逐渐减小 (2分)
(2)2S2-+SO32-+6H+=3S↓+3H2O(2分);
B中品红溶液褪色,C中无明显变化(1分);B中无明显变化,C中产生黑色沉淀 (1分)
(说明:在同一空格中答“B中品红溶液褪色,C中产生黑色沉淀”不得分)
(3)SO42-(2分)搅拌(或加热)(2分);乙(2分);
(4)4Na2SO3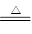 Na2S+3Na2SO4(2分)
Na2S+3Na2SO4(2分)
本题解析:(1)温度低于600℃,Na2SO3不分解,先反应生成NaHSO3,全部转化为NaHSO3后,再继续反应生成SO2和H2O,所以HSO3-的物质的量浓度变化趋势为先逐渐增大,后逐渐减小;(2)如果加热温度为700℃,Na2SO3分解,得到Na2S和Na2SO4,加盐酸反应2S2-+SO32-+6H+=3S↓+3H2O,还有大量气泡可能是H2S或SO2,所以现象为B中品红溶液褪色,C中无明显变化或者B中无明显变化,C中产生黑色沉淀。(3)分解产物中有Na2SO4,SO42-的鉴定甲方案加硝酸,把SO32-氧化为SO42-,不能证明它的存在,甲错误,乙正确。
本题难度:一般
2、实验题 现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
I?测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后__________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为__________________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是___________________________________________________________。
(5)乙同学按照甲同学认为改进实验,改进方法是______________但测得合金中铁的质量分数却偏高。你认为其中可能的原因是_________________。
Ⅱ?探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
参考答案:(1)把导管放入盛有水的水槽中,微热烧瓶,如果导管口有气泡产生,停止加热后导管产生一段水柱(2分);(其他合理答案同样给分)
(2)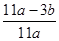 ×100% 或
×100% 或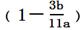 ×100%(2分);注意表达式有多种
×100%(2分);注意表达式有多种
(3)除去CO2中的SO2(1分);
(4)空气中CO2、H2O进入E管使b增大。(2分)
(5)在装置E的后边再连接一个与E相同的装置(2分)
反应产生的CO2气体未能完全排到装置E中,导致b偏低。(2分)
(6)常温下,Fe被浓H2SO4钝化,碳不与浓H2SO4反应(2分);
(7)2Fe + 6 H2SO4(浓) Fe2(SO4)3+ 3SO2↑ + 6H2O(2分);
Fe2(SO4)3+ 3SO2↑ + 6H2O(2分);
本题解析:(2)在装置A中发生Fe和C与浓硫酸的反应,产生CO2、SO2和铁的氧化物,装置B检验SO2,装置C吸收SO2,装置D干燥气体的,装置E是吸收CO2的,E增重的质量b是CO2的质量。
C---------CO2
1?1
b/44? b/44? C的质量:12b/44="3" b/11? Fe质量分数:(a-3 b/11)/a)×100%=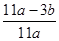 ×100%
×100%
(4)b的质量越大,碳的质量大,a不变,铁的质量会减小。
(5)再连接一个装置E是为了吸收充分的CO2。
本题难度:一般
3、实验题 (15分)为研究硫酸的性质,研究性学习小组设计以下两个实验。实验一:检查好装置的气密性后,在如图一所示甲的试管中加入足量的Fe合金(含有一定量的C),然后,加入少量浓硫酸。
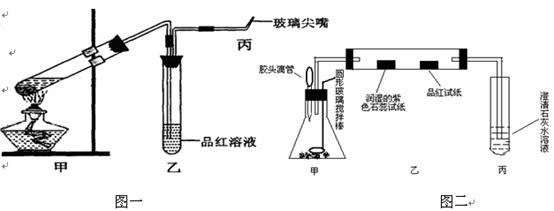
图一?图二
①.在未点燃酒精灯时,乙中没有明显现象,这是因为________________________?
为处理生成的有毒气体,还应在乙、丙之间接入干燥管,并在其中填充足量的?。
②.反应开始一段时间后,在丙处检验到某种无色无味气体,它是__________。
若甲中加入的是纯铁,丙处产生气体的速率没有前者的快,这是因为____________
实验二:
高一必修教材《浓硫酸与蔗糖反应的实验》这个传统实验是在敞口容器中进行,药品用量大,且浓硫酸与蔗糖反应过程中生成大量有毒气体直接排放到空气中,不符合“绿色化学”的新理念;对此实验进行新的设计和改进:取少量的蔗糖置于锥形瓶中加入几滴水,用胶头滴管滴加几滴浓硫酸,通过圆形玻璃搅拌棒不断搅拌;如上图二所示观察:
①.白色的蔗糖发黄再变黑,这是因为浓硫酸具有?性;一会儿迅速变成蜂窝状(形似“黑馒头” );写出发生的化学方程式:?
②.紫色石蕊试纸变红,品红试纸褪色,澄清石灰水出现浑浊,该小组同学认为有二氧化碳生成,你是否赞成此观点;若赞成就不填写;若不赞成,你将如何改进才能证明有二氧化碳生成:?
③.另一小组将紫色石蕊试纸更换为少许无水硫酸铜,结果没有观察到无水硫酸铜变蓝,证明浓硫酸具有??;
参考答案:实验一
①常温下,Fe遇浓硫酸钝化(1分),而C不与浓硫酸反应(1分); ?碱石灰(2分)
②氢气(或H2)(1分)?形成原电池加快反应速率?(2分)
实验二
①?脱水性 (2分) , C+2H2SO4(浓)  CO2↑+2SO2↑+2H2O?(2分)
CO2↑+2SO2↑+2H2O?(2分)
②在乙与丙之间增加酸性KMnO4除SO2? ,再用品红溶液检验SO2是否除尽
(2分,合理答案均给分)
③?吸水性 (2分)
本题解析:略
本题难度:一般
4、选择题 将等体积的SO2和Cl2充分混合,通入加有品红的氯化钡溶液,可观察到的现象是(? )
A.溶液快速褪色
B.溶液缓慢褪色
C.生成白色沉淀
D.生成浅黄色沉淀
参考答案:C
本题解析:
正确答案:C
Cl2+SO2+2H2O=H2SO4+2HCl,失去漂白性,生成的H2SO4与BaCl2生成沉淀。
本题难度:简单
5、选择题 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂
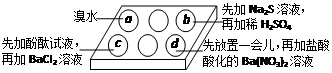
对实验现象的“解释或结论”错误的是
选项
| 实验现象
| 解释或结论
|
A
| a中溴水褪色
| 还原性:SO32—> Br—
|
B
| b中加硫酸后产生淡黄色沉淀
| SO32—和S2—在酸性条件下发生反应
|
C
| c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去
| SO32—+H2O HSO3—+OH—,所以滴入酚酞变红; HSO3—+OH—,所以滴入酚酞变红;
Ba2++SO32—→BaSO3↓(白),使水解平衡左移,红色褪去
|
D
| d中产生白色沉淀
| ?Na2SO3溶液已被氧化变质
|
?
参考答案:D
本题解析:A滴入溴水后褪色,说明亚硫酸钠具有还原性,被溴单质氧化为硫酸钠,正确;B中是滴入硫化钠溶液和稀硫酸,硫离子和亚硫酸根离子发生氧化还原反应生成淡黄色沉淀单质硫,发生反应的离子方程式是:SO32﹣+2S2﹣+6H+="3S↓+3" H2O,正确;C中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去,在Na2SO3溶液中,SO32﹣水解显碱性:SO32﹣+H2O?HSO3﹣+OH﹣,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32﹣═BaSO3↓(白色),水解平衡左移,氢氧根离子浓度减小,红色褪去,正确;D中无论是亚硫酸钠是被氧化还是未被氧化都会产生白色沉淀,错误。
本题难度:简单