1、选择题 在硫酸的工业制法中,下列生产操作与生产操作的主要原因
的说明都正确的是(?)
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
B.从沸腾炉出来的炉气需要净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全
2、填空题 浓硫酸具有以下A~F的性质:A酸性;B高沸点难挥发;C吸水性;D脱水性;E强氧化性;F溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为?。实验中往往有大量蓝色固体析出,可见浓硫酸在该实验中表现的性质有?。(浓硫酸性质用“A”、“B”、“C”、“D”、“E”、“F”填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为?。硫酸在该反应中表现的性质是?。
(3)在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式:?。与(2)中反应比较,反应条件不同的原因是?。
(4)向蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味的气体产生。写出产生有刺激气味气体的化学方程式:?。该实验中浓硫酸表现的性质有?。
3、填空题 焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
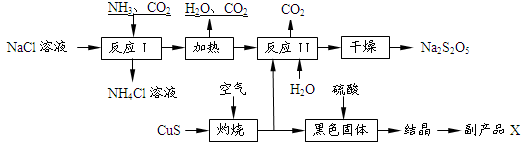
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)反应I的化学方程式为:?。
(2)“灼烧”时发生反应的化学方程式:?。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:?。
(4)副产品X的化学式是?。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为?。检验产品中含有碳酸钠杂质所需试剂是?(填编号)
①酸性高锰酸钾;②品红溶液;③澄清石灰水;④饱和碳酸氢钠溶液;⑤NaOH;⑥稀硫酸
4、选择题 将相同质量的两铜片分别和浓硝酸、稀硝酸(两者均过量)反应,下列叙述正确的是(?)
A.出现钝化现象:浓硝酸会,稀硝酸不会
B.消耗HNO3的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
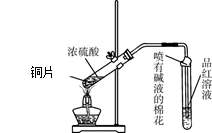
5、实验题 为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。
 ?
?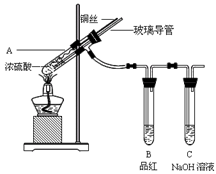
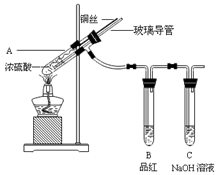 图1?图2
图1?图2
(1)比较两实验装置,图2装置的优点是:①?;②?。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是?。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
A.过量铁粉
B.氯化钡溶液
C.银粉
D.碳酸氢钠溶液