1、选择题 在硫酸的工业制法中,下列生产操作与生产操作的主要原因
的说明都正确的是(?)
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
B.从沸腾炉出来的炉气需要净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全
参考答案:D
本题解析:选项A中操作正确,但解释不正确,因为将矿石粉碎的目的是增大矿石与空气的接触面积,使之燃烧充分且完全;B选项的解释不对,因为净化炉气的目的是防止杂质使催化剂中毒和腐蚀管道;C选项的解释不对,因为使用催化剂的目的是加快化学反应的速率,并不能影响化学平衡,也就不能影响转化率。
本题难度:一般
2、填空题 浓硫酸具有以下A~F的性质:A酸性;B高沸点难挥发;C吸水性;D脱水性;E强氧化性;F溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为?。实验中往往有大量蓝色固体析出,可见浓硫酸在该实验中表现的性质有?。(浓硫酸性质用“A”、“B”、“C”、“D”、“E”、“F”填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为?。硫酸在该反应中表现的性质是?。
(3)在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式:?。与(2)中反应比较,反应条件不同的原因是?。
(4)向蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味的气体产生。写出产生有刺激气味气体的化学方程式:?。该实验中浓硫酸表现的性质有?。
参考答案:(1)2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O ACE
CuSO4+SO2↑+2H2O ACE
(2)2Cu+O2+2H2SO4 2CuSO4+2H2O A
2CuSO4+2H2O A
(3)Cu+H2O2+H2SO4=CuSO4+2H2O 过氧化氢的氧化性比氧气强
(4)2H2SO4(浓)+C CO2↑+2SO2↑+2H2O CDEF
CO2↑+2SO2↑+2H2O CDEF
本题解析:(1)浓硫酸有强氧化性,与铜共热的化学方程式为2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O,反应中硫元素化合价由+6降到+4,浓硫酸表现了强氧化性,同时有一部分H2SO4中各元素化合价均未改变,表现出了酸性,浓硫酸吸收了反应生成的水,使反应中有大量蓝色固体出现,表现了吸水性。(2)废铜屑倒入热的稀硫酸中并通入空气制备CuSO4溶液的反应方程式为2Cu+O2+2H2SO4
CuSO4+SO2↑+2H2O,反应中硫元素化合价由+6降到+4,浓硫酸表现了强氧化性,同时有一部分H2SO4中各元素化合价均未改变,表现出了酸性,浓硫酸吸收了反应生成的水,使反应中有大量蓝色固体出现,表现了吸水性。(2)废铜屑倒入热的稀硫酸中并通入空气制备CuSO4溶液的反应方程式为2Cu+O2+2H2SO4 2CuSO4+2H2O,硫酸表现出了酸性。
2CuSO4+2H2O,硫酸表现出了酸性。
(3)过氧化氢有强氧化性,常温下向过氧化氢与稀硫酸的混合溶液中加入铜片发生反应的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O,由此可证明过氧化氢的氧化性大于氧气。(4)根据题给现象,说明浓硫酸有脱水性、吸水性、强氧化性,同时,浓硫酸溶于水会放出大量的热,可发生反应2H2SO4(浓)+C CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
本题难度:一般
3、填空题 焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
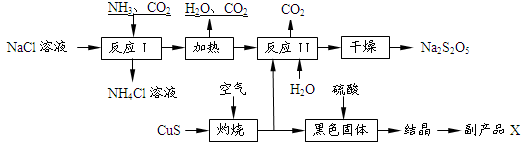
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)反应I的化学方程式为:?。
(2)“灼烧”时发生反应的化学方程式:?。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:?。
(4)副产品X的化学式是?。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为?。检验产品中含有碳酸钠杂质所需试剂是?(填编号)
①酸性高锰酸钾;②品红溶液;③澄清石灰水;④饱和碳酸氢钠溶液;⑤NaOH;⑥稀硫酸
参考答案:(1)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl?
(2)2CuS+3O2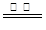 2CuO+2SO2?
2CuO+2SO2?
(3)S2O52-+2H+=2SO2↑+H2O?
(4)CuSO4?5H2O?
(5)2∶1?①③⑥或①②③⑥
本题解析:(1)根据流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠;(2)CuS与氧气反应生成黑色氧化铜和二氧化硫气体;(3)Na2S2O5中硫元素的化合价为+4价,生成二氧化硫化合价没变;(4)氧化铜与硫酸反应生成硫酸铜,结晶得出硫酸铜晶体;(5)反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2 SO2+H2O= 2NaHSO3+ CO2,为了控制杂质,二氧化硫与碳酸氢钠应按反应方程式中比例关系反应;检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用的澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液,并用品红(或酸性高锰酸钾)检验是否除净,或直接用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净。
本题难度:一般
4、选择题 将相同质量的两铜片分别和浓硝酸、稀硝酸(两者均过量)反应,下列叙述正确的是(?)
A.出现钝化现象:浓硝酸会,稀硝酸不会
B.消耗HNO3的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
参考答案:B
本题解析:铜与浓硝酸、稀硝酸反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2?↑+2H2O ,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O A、浓硝酸、稀硝酸与铜均不会出现钝化现象,错误;B、由铜与浓硝酸、稀硝酸反应方程式可知,等质量的铜分别与浓、稀硝酸反应,浓硝酸消耗的物质的量多,正确;C、根据反应方程式知,铜与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,二氧化氮是红棕色气体,一氧化氮是无色气体,错误;D、根据方程式知,铜元素的化合价均由0价变为+2,1mol铜参加反应转移2mol电子,相同质量的铜与过量浓、稀硝酸反应转移电子数相等,错误。
本题难度:一般
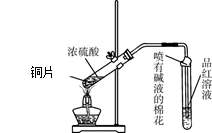
5、实验题 为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。
 ?
?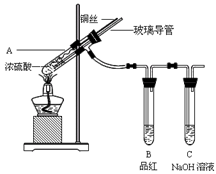
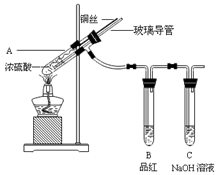 图1?图2
图1?图2
(1)比较两实验装置,图2装置的优点是:①?;②?。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是?。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
A.过量铁粉
B.氯化钡溶液
C.银粉
D.碳酸氢钠溶液