1、简答题 I.已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸K=1.着5×10-5
碳酸K1=4.30×10-着K2=5.61×10-11
亚硫酸K1=1.54×10-2K2=1.02×10-着
(1)写出碳酸的第一级电离平衡常数表达式:K1=______.
(2)在相同条件下,试比较CH3COONa、Na2CO3和Na2SO3水溶液的碱性强弱:______>______>______.
(3)在相同条件下,试比较同浓度同体积H2SO3、NaHSO3和Na2SO3溶液中粒子的数目:______>______>______.
(4)若保持温度不变,在醋酸溶液中加入1量盐酸,下列量会变5的是______(填序号).
A.c(CH3COO-)B.c(H+)C.醋酸电离平衡常数D.醋酸的电离程度
II.某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS
KSP
8.3×10-1着
5.6×10-8
6.3×10-50
着.1×10-9
1.2×10-15
3.4×10-28
|
(5)你认为往废水中投入______(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(6)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.11着%(ρ≈1g?mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8mol?L-1,问该工厂处理后的废水中c(Ag+)=______[已知:Ksp(AgCl)=c(Ag+)?c(Cl-)=1.8×10-10mol2?L-2].
参考答案:(1)碳酸的第一级电离方程式为H2CO3?H++HCO3-,电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值,则K1=c(H+)c(HCO-3)c(H2CO3),故答案为:c(H+)c(HCO-3)c(H2CO3);
(2)CH3COONa、Na2CO3和Na2SO3三种盐对应的酸为醋酸、HCO3-、HSO3-,由醋酸的电离平衡常数K>亚硫酸的K2>碳酸的K2,酸性越弱,盐中离子的水解就越大,则水解程度最小的为醋酸钠,水解程度最大的为碳酸钠,故答案为:Na2CO3;Na2SO3;CH3COONa;
(3)相同条件下,同浓度同体积H2SO3、NaHSO3和Na2SO3溶液中,三种物质的物质的量相同,只有亚硫酸为弱电解质,则粒子的数目最少,而NaHSO3和Na2SO3为强电解质,相同物质的量时亚硫酸钠中粒子的数目多,又NaHSO3和Na2SO3溶液中水解与电离的程度都很小,故答案为:Na2SO3;NaHSO3;H2SO3;
(4)因加入盐酸,醋酸的电离平衡逆向移动,则c(CH3COO-)减小,醋酸的电离程度减小,但温度不变,则醋酸电离平衡常数不变,加盐酸时c(H+)增大,故答案为:Aj;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;&nssp;
(v)由表格中的溶度积数据可知,Ag2S和PsS的溶度积最小,则加入Na2S沉淀效果最好,故答案为:s;&nssp;&nssp;
(l)废水中NaCl的质量分数为0.117%(ρ≈1g?mL-1),c(Cl-)=c(NaCl)=1000×1g/mL×0.117%v8.vg/mol=0.02mol/L,
Ksp(AgCl)=c(Ag+)?c(Cl-)=1.8×10-10mol2?L-2,
则c(Ag+)=1.8×10-100.02=下×10-下mol?L-1,故答案为:下×10-下mol?L-1.
本题解析:
本题难度:一般
2、选择题 常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性。则下列各项正确的是? ( )。
A.混合前:pH(CH3COOH)+pH(NaOH)=14
B.混合后:c(Na+)=c(CH3COO-)+c(OH-)
C.混合前:c(CH3COOH)>c(NaOH)
D.混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
参考答案:C
本题解析:混合前,若pH(CH3COOH)+pH(NaOH)=14,则,c(H+)=c(OH-),CH3COOH为弱电解质,部分电离,c(CH3COOH)比c(NaOH)大得多,混合后不会呈中性而是呈酸性,故A不正确,C正确;混合后溶液呈中性,则c(H+)=c(OH-),根据电荷守恒,c(Na+)=c(CH3COO-),故B、D不正确。
本题难度:一般
3、选择题 能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
①将水加热煮沸?
②向水中投入一小块金属钠?
③向水中通CO2④向水中通NH3?
⑤向水中加入明矾晶体?
⑥向水中加入NaHCO3固体
⑦向水中加NaHSO4固体.
A.①③⑥⑦
B.①③⑤⑥
C.⑤⑦
D.⑤
参考答案:①加热时能促进水的电离,但是c(H+)=c(OH-),溶液呈中性,故①错误;
②加入金属钠,和水电离出的氢离子反应生成氢氧化钠和氢气,从而促进水的电离,但溶液中c(H+)<c(OH-),故②错误;
③二氧化碳溶于水生成碳酸,溶液中的c(H+)>c(OH-),但酸对水的电离起抑制作用,故③错误;
④NH3?溶于水生成氨水,溶液中的c(H+)<c(OH-),导致溶液呈碱性,且氨水抑制水电离,故?④错误;?
⑤向水中加入明矾,铝离子水解对水的电离起促进作用,电离后的溶液显酸性,溶液中的c(H+)>c(OH-),故⑤正确;?
⑥向水中加入NaHCO3,碳酸氢钠中的碳酸氢根水解而使溶液显碱性,即溶液中的c(H+)<c(OH-),故⑥错误;
⑦向水中加NaHSO4固体,硫酸氢钠在水中完全电离出钠离子、氢离子、硫酸根离子,溶液中的c(H+)>c(OH-),但氢离子抑制水电离,故⑦错误,
故选D.
本题解析:
本题难度:简单
4、填空题 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)

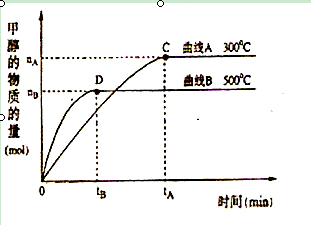
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)常温下,某纯碱溶液中滴入酚酞,溶液呈红色。说明该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
参考答案:(1)B (1分); < (1分);
(2)K=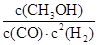 (1分) ; 减小 (1分) ;
(1分) ; 减小 (1分) ; 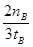 mol?L-1?min-1 (1分);
mol?L-1?min-1 (1分);
(3)碱 (1分); 向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确 (2 分)。(其它合理答案也给分)
本题解析:(1)醋酸为弱电解质,其溶液存在电离平衡,与Zn反应使平衡向右移动,pH变化小,故B曲线表示醋酸的pH变化曲线;pH相同醋酸的物质的量大,故与醋酸反应的Zn质量大。
(2)按照平衡常数的含义可得平衡常数表达式;随着反应的进行H2浓度自己减小,所以氢气的平均反应速率减小;v(H2)="2" v(CH3OH)=2×nBmol÷3L÷tBmin=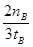 mol?L-1?min-1。
mol?L-1?min-1。
(3)碱性溶液使酚酞变红;根据NaOH和Na2CO3的性质,N a2CO3与BaCl2反应生成BaCO3沉淀而NaOH与BaCl2不反应,所以用BaCl2溶液检验。
考点:本题考查弱电解质的电离平衡、化学平衡常数、化学反应速率的计算、物质的检验。
本题难度:困难
5、选择题 已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
参考答案:B
本题解析:
本题难度:一般