1、选择题 下列叙述中,不正确的是( )
A.0.1?mol?L-1CH3COOH溶液加水稀释,n(H+)增大
B.0.2?mol?L-1盐酸与等体积0.05?mol?L-1Ba(OH)2溶液混合后,溶液pH为1
C.向AgCl悬浊液中滴入KI溶液,生成AgI沉淀,说明AgCl的溶解度大于AgI
D.若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3)
参考答案:A、0.1?mol?L-1CH3COOH溶液加水稀释促进弱电解质醋酸的电离,离子浓度减少.n(H+)物质的量增加,故A正确;
B、0.2?mol?L-1盐酸中的氢离子浓度为0.2mol/L,0.05?mol?L-1Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,等体积混合按照H++OH-=H2O反应后,剩余氢离子浓度=0.2-0.12=0.05mol/L,pH>1,故B错误;
C、依据反应向更难的方向进行,向AgCl悬浊液中滴入KI溶液,生成AgI沉淀,说明AgCl的溶解度大于AgI,故C正确;
D、NH4HCO3溶液中的碳酸氢根离子水解促进铵根水解、NH4HSO4溶液中的氢离子抑制铵根离子的水解,NH4NO3溶液中只存在铵根离子的水解,若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则需要溶质的浓度为c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3),故D正确;
故选B.
本题解析:
本题难度:一般
2、填空题 (6分)在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。请回答:
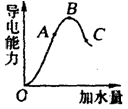
(1)“O”点导电能力为“0”的理由是 。
(2)A、B、C三点pH由大到小的顺序是__________________。
(3)A、B、C三点电离度最大的是_____________。
参考答案:(6分)⑴冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电。
(2)C>A>B (3)C
本题解析:
⑴溶液的导电能力与溶液中离子浓度和离子所带电荷有关,冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电。⑵由图可以确定溶液中H+浓度由小到大的次序为C、A、B,pH由大到小的顺序是C>A>B;⑶溶液越稀电离程度越大,C点电离度最大。
本题难度:一般
3、选择题 下列说法正确的是( )
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)=c(Cl-)
C.0.1mol?L-的氯化铵溶液与0.05mol?L-的氢氧化钠溶液等体积混合溶液中离子浓度c(Cl-)>c(NH4+)>c(Na+)>c(OH-)
D.0.1mol?L-1硫化钠溶液中离子浓度关系c(Na+)=c(S2-)+c(HS-)+c(H2S)
参考答案:A.在醋酸和醋酸钠的溶液中,若水解大于电离,溶液的pH>7,故A错误;
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则c(H+)=c(OH-),由电荷守恒可知,c(H+)+c(NH4+)=
c(Cl-)+c(OH-),则c(NH4+)=c(Cl-),故B正确;
C.0.1mol?L-的氯化铵溶液与0.05mol?L-的氢氧化钠溶液等体积混合后溶液中存在等物质的量的NaCl、NH4Cl、NH3.H2O,溶液显碱性,电离大于水解,则c(Cl-)>c(NH4+)>c(Na+)>c(OH-),故C正确;
D.硫化钠的化学式为Na2S,则0.1mol?L-1硫化钠溶液中离子浓度关系12c(Na+)=c(S2-)+c(HS-)+c(H2S),故D错误;
故选BC.
本题解析:
本题难度:一般
4、选择题 当CH3COOH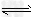 CH3COO-+H+已达平衡,若要使醋酸的电离平衡向左移动和溶液的pH值都减小,应加入的试剂是?
CH3COO-+H+已达平衡,若要使醋酸的电离平衡向左移动和溶液的pH值都减小,应加入的试剂是?
[? ]
A.CH3COONa?
B.NH3·H2O?
C.HCl?
D.H2O?
参考答案:C
本题解析:
本题难度:一般
5、选择题 现有常温下的四份溶液:①0.01 mol/L CH3COOH溶液;②0.0l mol/L HC1溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若pH=7,则消耗溶液的体积:②>③
C.将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性
D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①<②
参考答案:B
本题解析:A、①②③④相比,①中的氢离子浓度最小,对水的电离影响最弱,所以①中水的电离程度最大,错误;B、pH=12的氨水中一水合氨的浓度大于0.01mol/L,所以等体积的②③混合,溶液会显碱性,所以要使溶液呈中性,碱应小于酸的体积,即②>③,正确;C、①④的物质浓度相等,二者混合,所得溶液若为醋酸和醋酸钠的溶液时,有c(CH3COO-)>c(H+)成立,但此时溶液为酸性,错误;D、对于③④,pH相同,稀释相同的倍数后,由于一水合氨是弱碱会促进其电离,所以氨水的碱性强于氢氧化钠;对于①②,二者的物质的量浓度相同,②中的氢离子浓度远远大于①,所以稀释相同的倍数后,尽管会促进①中的醋酸分子的电离,但氢离子浓度仍会小于②,所以①②相比,②的pH小于①,酸性更强,所以错误,答案选B。
本题难度:一般