1、填空题 ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下:
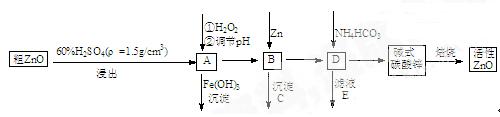
已知此溶液中Fe2+、 Fe3+、? Cu2+?、 Zn2+形成氢氧化物的pH如下表
离子
| 开始沉沉淀的pH
| 完全沉淀的pH
|
Fe2+
| 6.4
| 8.4
|
Fe3+
| 2.4
| 3.1
|
Cu2+
| 5.2
| 6.7
|
Zn2+
| 6.8
| 9
|
(1)实验室中用98%H2SO4来配制稀硫酸所需使用的玻璃仪器有:胶头滴管、_______、_______、_______。
(2)在A中加H2O2的目的之一是使溶液pH升高,使Fe3+沉淀完全。另外还有一个目的是?;在A中?(填”能”或”不能”)使Fe2+直接沉淀除去;
(3)要使A溶液顺利成为B溶液, 溶液的pH应控制在??;? B中加入Zn,既能降低氢离子浓度又能?;
(4)书写碱式碳酸锌焙烧制备活性ZnO的化学方程式?.
参考答案:
本题解析:略
本题难度:一般
2、填空题 I. 现有下列8种物质
①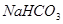 ;②
;②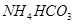 ;③
;③ ;④HF;⑤
;④HF;⑤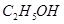 ;⑥
;⑥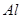 ;⑦食盐水;⑧
;⑦食盐水;⑧
其中属于强电解质的是_____________(填序号,下同),既能跟盐酸反应又能跟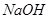 溶液反应的是_____________。
溶液反应的是_____________。
II. 现有一瓶浓度为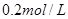 的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取
的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取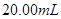 该酸
该酸 溶液,逐滴加入
溶液,逐滴加入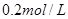 的氢氧化钠溶液,恰好反应完全时所需碱液体积为
的氢氧化钠溶液,恰好反应完全时所需碱液体积为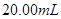 ,请用化学用语回答:
,请用化学用语回答:
(1)该酸不可能是____________;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为____________,用离子方程式说明溶液呈碱性的原因_________ _______________。
_______________。
III. A、B、C、D均为可溶于水的固体,组成它们的离子有:
?分别取它们的水溶液进行实验,结果 如下:
如下:
①A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会消失。
②C与D反应有红褐色沉淀生成并放出气体。
③B与C反应有白色沉淀生成并放出气体。
(1)写出它们的化学式:A___________,B___________,C___________,D___________。
(2)写出③中B与C反应的离子方程式_________________________________。
参考答案:I. ①②③?①②⑥
II. (1) ?(2)
?(2)


III. (1) ?
? ?
? ?
?
(2)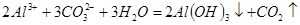
本题解析:略
本题难度:一般
3、实验题 (4分)如图所示,在一烧杯中盛有H2SO4溶液, 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
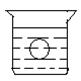
 (1)该实验中,观察到的现象有
(1)该实验中,观察到的现象有
①?,?
②?。
(2)写出该实验中反应的离子方程式?
?。
参考答案:(1)溶液里有白色沉淀产生;(2)小球下沉到烧杯底;(3)Ba2++2OH-+2H++SO42- =BaSO4↓+4H2O;
本题解析:随着Ba(OH)2溶液的注入,会与H2SO4溶液反应生成沉淀,导致溶液的浓度越来越小,小球受到的浮力逐渐减小,最终会使小球下沉到烧杯底。
本题难度:简单
4、选择题 下列反应的离子方程式正确的是
A.用惰性电极电解MgCl2溶液:2Cl-+2H2O═Cl2↑+H2↑+2OH-
B.硫化钠发生水解:S2-+H2O=HS-+OH-
C.少量小苏打溶液滴入Ba(OH)2溶液中:HCO-3十Ba2++OH-=BaCO3↓+H2O
D.向NH4HSO4溶液中加入NaOH溶液至混合液为中性:H++OH-=H2O
参考答案:C
本题解析:分析:根据离子方程式书写要求来判断,如看是否守恒(质量、电荷、得失电子),是否符合客观事实,化学式拆分、化学符号使用是否正确,反应物用量与其反应是否一致,是否忽略隐含离子等.
解答:A、因电解时在阴极附近产生了大量OH-,OH-能与Mg2+反应:Mg2++2OH-=Mg(OH)2↓,故A错误;
B、因水解反应为可逆反应,S2-的水解用“?”而不用“=”,故B错误;
C、因HCO-3+OH-=CO32-+H 2O,所以少量小苏打溶液滴入Ba(OH)2溶液中发生NaHCO3+Ba(OH)2=BaCO3↓+H2O+NaOH,故C正确;
D、因NH4HSO4溶液中NH+4与OH-反应:NH+4+OH-=NH3?H2O,故D错误;
故选C.
点评:本题考查了离子方程式正误判断的方法,只要掌握一些常见的判断方法,就可以做到迎刃而解了.
本题难度:一般
5、选择题 下列离子组在溶液中能大量共存的是
A.Fe3+、SCN-、I-、K+
B.K+、Al3+、SO42-、MnO4-
C.H+、NO3-、Fe2+、Na+
D.Cu2+、NH4+、Br-、OH-
参考答案:B
本题解析:试题分析:铁离子与硫氰酸跟离子容易发生显色反应,铁离子还能氧化碘离子,故A选项错误;K+、Al3+、SO42-、MnO4-之间不能反应,故B选项正确;亚铁离子在酸性条件下容易被硝酸根离子氧化,故C选项错误;铜离子与氢氧根离子容易反应生成氢氧化铜沉淀,铵根离子与氢氧根离子容易反应生成一水合氨或氨气、水,故D选项错误。
考点:考查离子共存,主要涉及离子之间反应生成难溶物、难电离物和易挥发物、氧化还原反应、显色反应、复水解反应等。
本题难度:一般