| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《键参数——键能、键长与键角》高频试题特训(2019年最新版)(六)
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了种观点: 甲: 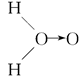 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)_____________________________________________________________。 ②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:____________________________________________________________。 参考答案:(1)BD 本题解析:本题综合考查配位键的形成和配合物的性质。解题时要注意配位键形成条件中的一方提供孤对电子,另一方提供空轨道。 本题难度:一般 3、选择题 含有离子键的物质是( ) 参考答案:A.N2中只有非极性共价键,故A不选; 本题解析: 本题难度:简单 4、选择题 X、Y、Z、W、R均是短周期元素,它们在元素周期表中的相对位置如图所示,其中W的最高正化合价与最低负化合价绝对值相等.下列说法正确的是( )
A.X、Y形成的某种化合物可作为呼吸面具中X2的来源 B.Z、W、R分别与X形成的化合物的水化物都是强酸 C.气态氢化物的热稳定性:HmX>HmR>WHn D.化合物YmX和YmR中,阳离子半径均大于阴离子半径 参考答案:W的最高正化合价与最低负化合价绝对值相等,最高正化合价与最低负化合价绝对值之和一定等于8,根据W的位置,可知W硅,Z为Al,Y为Na,R为S,X为O, 本题解析: 本题难度:一般 5、选择题 下列说法正确的是 参考答案:C 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《物质的组成》高频.. | |