1、选择题 下列有关热化学方程式的叙述正确的是( )
A.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8KJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=2×283.0kJ/mol
C.在稀溶液中H+(aq)+OH-(aq)=H2O(l)△H=-57.2?kJ/mol?若将含0.5?mol?H2SO4的浓硫酸与含1?mol?NaOH的稀溶液混合,放出的热量等于57.2?kJ
D.己知2H2(g)+O2(g)=2H2O(l)△H1,2H2(g)+O2(g)=2H2O(g)△H2,则△H1>△H2
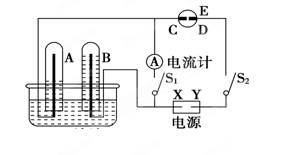
2、填空题 CO2的固定和利用在降低温室气体排放中具有重要作用,从CO2加氢合成甲醇不仅可以有效缓解减排压力,还是其综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应CO2+3H2 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
(1)提高甲醇产率的措施是 。
(2)分析图中数据可知,在220 ℃、5MPa时,CO2的转化率为 ,再将温度降低至
140℃,压强减小至2MPa,化学反应速率将 (填“增大、减小 或 不变“ 下同),CO2的转化率将 。
(3)200℃时,将0.100molCO2和0.275molH2充入1L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K= 。(要求写出算式和计算结果)
(4)已知已知:CO的燃烧热△H=-283.0KJ/mol、2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol、
CO(g)+2H2(g)=CH3OH(g) △H=-90.1KJ/mol,写出CO2与H2合成甲醇的热化学方程式 。
3、计算题 已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ); △H = -571.6kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g ); △H = -483.6kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); △H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比。
4、简答题 过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH).其化学方程式为:

请填空:
(1)写出上述反应的平衡常数表达式______:
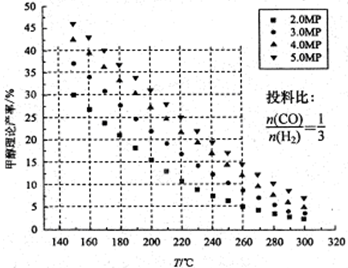
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如图所示.下列说法正确的是______(填序号)
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
mol?(L?min)-1
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,增大
(3)25℃,1.01×105Pa时,16g?液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,该反应的热化学方程式为:______.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是______;正极的电极反应式:______.
5、填空题 (1)已知:C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) △H=-2220.0kJ/mol
H2O(1) ===H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式 。
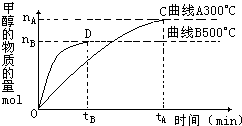
(2)在如图所示的实验装置中,E为一张用淀粉碘化钾溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极。在A、B中充满AgNO3溶液后倒立于盛有AgNO3溶液的水槽中,再分别插入铂电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,B电极质量增重,A极产生无色气体。请回答下列问题:
① 写出D电极反应式: ;
②写出水槽中电解AgNO3溶液总反应的离子方程式: ,阴极增重2.16 g,则阳极上放出的气体在标准状况下的体积是____ _L。