1、选择题 下列有关热化学方程式的叙述正确的是( )
A.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8KJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=2×283.0kJ/mol
C.在稀溶液中H+(aq)+OH-(aq)=H2O(l)△H=-57.2?kJ/mol?若将含0.5?mol?H2SO4的浓硫酸与含1?mol?NaOH的稀溶液混合,放出的热量等于57.2?kJ
D.己知2H2(g)+O2(g)=2H2O(l)△H1,2H2(g)+O2(g)=2H2O(g)△H2,则△H1>△H2
参考答案:B
本题解析:
本题难度:一般
2、填空题 CO2的固定和利用在降低温室气体排放中具有重要作用,从CO2加氢合成甲醇不仅可以有效缓解减排压力,还是其综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应CO2+3H2 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
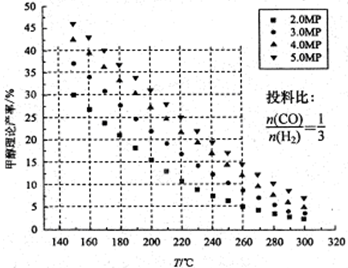
(1)提高甲醇产率的措施是 。
(2)分析图中数据可知,在220 ℃、5MPa时,CO2的转化率为 ,再将温度降低至
140℃,压强减小至2MPa,化学反应速率将 (填“增大、减小 或 不变“ 下同),CO2的转化率将 。
(3)200℃时,将0.100molCO2和0.275molH2充入1L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K= 。(要求写出算式和计算结果)
(4)已知已知:CO的燃烧热△H=-283.0KJ/mol、2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol、
CO(g)+2H2(g)=CH3OH(g) △H=-90.1KJ/mol,写出CO2与H2合成甲醇的热化学方程式 。
参考答案:(1)降温、加压(2分) (2)25%(2分) 减小(2分) 增大(2分)
(3) =
=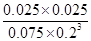 =1.04 (3分)
=1.04 (3分)
(4)CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ?H=-48.9 kJ/mol(3分)
本题解析:(1)根据图像可知,随着温度的升高,甲醇的产率降低,这说明正方应是放热反应。再温度相同时,增大压强,甲醇的产率增大,所以提高甲醇产率的措施是降温、加压。
(2)分析图中数据可知,在220 ℃、5MPa时,甲醇的产率是25%。根据碳原子守恒,1molCO2生成1mol甲醇,因此甲醇的产率就是CO2的转化率,所以CO2的转化率为25%。降温并同时降低压强,反应速率减小。由于正方应是放热的体积减小的可逆反应,因此降温和降低压强平衡均向正反应方向移动,所以CO2的转化率增大。
(3) CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
起始浓度(mol/L)0.100 0.275 0 0
转化浓度(mol/L)0.0250 0.0750 0.0250 0.0250
平衡浓度(mol/L)0.0750 0.200 0.0250 0.0250
所以该温度下反应的平衡常数K= =
=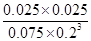 =1.04
=1.04
(4)CO的燃烧热△H=-283.0KJ/mol,则有热化学方程式①2CO(g)+O2(g)=2CO2(g) △H=-566.0KJ/mol。又因为反应②2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol、③CO(g)+2H2(g)=CH3OH(g) △H=-90.1KJ/mol,所以根据盖斯定律可知,(③×2-①+②)÷2,及得到反应CO2(g)+3H2(g)===CH3OH(g)+H2O(g),所以该反应的反应热?H=(-90.1KJ/mol×2+566.0KJ/mol-483.6KJ/mol)÷2=-48.9 kJ/mol。
考点:考查考查外界条件对反应速率和平衡状态的影响;反应速率和平衡常数的计算以及盖斯定律的应用
本题难度:困难
3、计算题 已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ); △H = -571.6kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g ); △H = -483.6kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); △H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比。
参考答案:V(CH4)
本题解析:
本题难度:一般
4、简答题 过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH).其化学方程式为:

请填空:
(1)写出上述反应的平衡常数表达式______:
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如图所示.下列说法正确的是______(填序号)
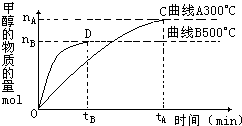
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
mol?(L?min)-1
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,增大
(3)25℃,1.01×105Pa时,16g?液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,该反应的热化学方程式为:______.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是______;正极的电极反应式:______.
参考答案:(1)根据K=生成物的浓度幂之积除以反应物的浓度幂之积,得出K=c(CH3OH)?c(H2O)c(CO2)?c3(H2),故答案为:K=c(CH3OH)?c(H2O)c(CO2)?c3(H2);
(2)A、化学反应速率等于单位时间内物质浓度的变化量,甲醇的平均反应速率v(CH3OH)=nA2tAmol?(L?min)-1,故A错误;
B、根据图示信息:升高温度,甲醇的物质的量减少,所以反应逆向进行,即反应是放热反应,对于放热反应,升高温度,平衡常数减小,故B错误;
C、根据图示信息:升高温度,甲醇的物质的量减少,所以反应逆向进行,即反应是放热反应,故C正确;
D、C点时反应达到平衡状态,升高温度,对于该放热反应,平衡逆向进行,所以n(H2)n(CH3OH)增大,故D正确;
故选CD.
(3)16g?液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,则1mol?液态甲醇完全燃烧,当恢复到原状态时,放出725.8kJ的热量,即热化学方程式为:
CH3OH(l)+32?O2=CO2(g)+2H2O(l)△H=-725.8kJ/mol,故答案为:CH3OH(l)+32?O2=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(4)甲醇为原料的燃料电池中,燃料甲醇为负极,发生失电子的氧化反应,氧气是正极,发生得电子得还原反应,根据所给试剂,只能选择氢氧化钠为电解质,在碱性环境下,氧气的放电情况为:O2+2H2O+4e-=4OH-,故答案为:甲醇;O2+2H2O+4e-=4OH-.
本题解析:
本题难度:一般
5、填空题 (1)已知:C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) △H=-2220.0kJ/mol
H2O(1) ===H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式 。
(2)在如图所示的实验装置中,E为一张用淀粉碘化钾溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极。在A、B中充满AgNO3溶液后倒立于盛有AgNO3溶液的水槽中,再分别插入铂电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,B电极质量增重,A极产生无色气体。请回答下列问题:
① 写出D电极反应式: ;
②写出水槽中电解AgNO3溶液总反应的离子方程式: ,阴极增重2.16 g,则阳极上放出的气体在标准状况下的体积是____ _L。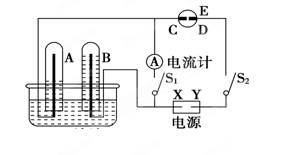
参考答案:(1)C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) △H=-2044kJ/mol(3分)
(2)2I--2e-=I2(2分);4Ag++2H2O 4Ag+4H++O2↑(2分);0.112(2分)
4Ag+4H++O2↑(2分);0.112(2分)
本题解析:(1)已知:①C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) △H=-2220.0kJ/mol、②H2O(1) ===H2O(g);△H=+44.0kJ/mol,则根据盖斯定律可知①+②×4即得到丙烷燃烧生成CO2和气态水的热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(g),所以该反应的反应热△H=-2220.0kJ/mol+44.0kJ/mol×4=-2044kJ/mol。
(2)①切断电源开关S1,闭合开关S2,则构成电解池。通直流电一段时间后,B电极质量增重,这说明B电极是阴极,溶液中的金属阳离子放电析出金属。A极是阳极,溶液中的OH-放电产生无色气体氧气。所以Y电极是电源的负极,X是正极。则D电极是阴极,溶液中的碘离子放电生成单质碘,电极反应式为2I--2e-=I2。
②惰性电极电解硝酸银溶液生成硝酸、氧气和银,离子方程式为4Ag++2H2O 4Ag+4H++O2↑。阴极增重2.16 g,即银的质量是2.16g,物质的量是2.16g÷108g/mol=0.02mol。所以根据方程式可知,生成氧气的物质的量=0.02mol÷4=0.005mol。因此在标准状况下的体积=0.005mol×22.4L/mol=0.112L。
4Ag+4H++O2↑。阴极增重2.16 g,即银的质量是2.16g,物质的量是2.16g÷108g/mol=0.02mol。所以根据方程式可知,生成氧气的物质的量=0.02mol÷4=0.005mol。因此在标准状况下的体积=0.005mol×22.4L/mol=0.112L。
考点:考查盖斯定律的应用、电化学原理的应用、判断与计算
本题难度:困难