1、填空题 1molC、1molCO分别按下式反应,回答下列问题:C(S)+1/2O2(g)=CO(g)?放出110.5KJ热量?CO(g)+1/2O2(g)=CO2(g)?放出283.0KJ热量? C(S)+O2(g)=CO2(g)?放出393.5KJ热量
(1)结合数据和反应产物说明,煤炭充分燃烧优点是:______,______.
(2)单质碳通过先与氧气反应生成CO(g),再与氧气反应生成CO2(g),所放出的热量之和______(填大于、等于或小于)相同质量的碳与氧气完全燃烧生成CO2(g)所放出的热量
(3)已知C(金刚石,S)+O2(g)=CO2(g)?放出热量为Q1 C(石墨,S)+O2(g)=CO2(g)?放出热量为Q2,且Q1>Q2则C(金刚石,S)=C(石墨,S)为______(填吸热或放热)反应,放出热量为______KJ(用Q1、Q2表示)
2、填空题 (16分)Ⅰ.已知:
4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石) △H=-1080.9kJ/mol
4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol
试写出固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式 。
Ⅱ.硝基苯甲酸乙酯在OH— 存在下发生水解反应:O2NC6H4COOC2H5+OH-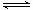 O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示:
t/s
| 0
| 120
| 180
| 240
| 330
| 530
| 600
| 700
| 800
|
α/%
| 0
| 33
| 42
| 49
| 59
| 73
| 74
| 75
| 75
|
回答下列问题:
(1)该反应在330~530s的平均反应速率为 (只列出算式,不做运算)。
(2)试计算某温度下该反应的平衡常数(写出计算过程)。
(3)为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 ,(写2条)。
Ⅲ.(1)下图装置中,开始电解时,Al电极反应式为 ,石墨电极反应式为 。
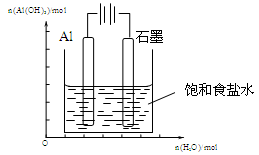
(2)通电一段时间后测得有0.6mol电子转移,作出Al(OH)3物质的量与消耗H2O的物质的量的的图象(反应物足量,作出标注)。
3、选择题 下列有关热化学方程式及其叙述正确的是
[? ]
A.氢气的燃烧热为285.5 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) △H=+285.5kJ/mol
B.1mol甲烷完全燃烧生成CO2和H2O(l)时放出890 kJ热量,它的热化学方程式为:1/2CH4(g)+O2(g)=
1/2CO2(g)+H2O(l) △H=-445kJ/mol
C.已知2C(s)+O2(g)=2CO(g) △H= -221 kJ/mol,则C(碳)的燃烧热为110.5 kJ/mol
D.HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol
4、填空题 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) 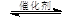 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2) / n(CO2)]
| 500 K
| 600 K
| 700 K
| 800 K
|
1.5
| 45%
| 33%
| 20%
| 12%
|
2.0
| 60%
| 43%
| 28%
| 15%
|
3.0
| 83%
| 62%
| 37%
| 22%
|
①若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比[n(H2) / n(CO2)],则K将 。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
。若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 g。
5、选择题 已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2( g ) + 3H2( g ) = 2NH3( g ) ΔH="—92.4" KJ/mol,则N≡N键的键能是
A.431 KJ/mol
B.946 KJ/mol
C.649 KJ/mol
D.869 KJ/mol