1、填空题 1molC、1molCO分别按下式反应,回答下列问题:C(S)+1/2O2(g)=CO(g)?放出110.5KJ热量?CO(g)+1/2O2(g)=CO2(g)?放出283.0KJ热量? C(S)+O2(g)=CO2(g)?放出393.5KJ热量
(1)结合数据和反应产物说明,煤炭充分燃烧优点是:______,______.
(2)单质碳通过先与氧气反应生成CO(g),再与氧气反应生成CO2(g),所放出的热量之和______(填大于、等于或小于)相同质量的碳与氧气完全燃烧生成CO2(g)所放出的热量
(3)已知C(金刚石,S)+O2(g)=CO2(g)?放出热量为Q1 C(石墨,S)+O2(g)=CO2(g)?放出热量为Q2,且Q1>Q2则C(金刚石,S)=C(石墨,S)为______(填吸热或放热)反应,放出热量为______KJ(用Q1、Q2表示)
参考答案:(1)结合数据和反应产物说明,可知煤炭充分燃烧产生的热量多和产物无污染,故答案为:产生的热量多;产物无污染;
(2)已知:①C(S)+1/2O2(g)=CO(g)△H=-110.5KJ?mol-1,
? ②CO(g)+1/2O2(g)=CO2(g)△H=-283.0KJ?mol-1,
利用盖斯定律将①+②可得:
? ? C(S)+O2(g)=CO2(g)△H=(-110.5kJ?mol-1)+(-283.0kJ?mol-1)=-393.5KJ?mol-1,
即单质碳通过先与氧气反应生成CO(g),再与氧气反应生成CO2(g),所放出的热量之和等于相同质量的碳与氧气完全燃烧生成CO2(g)所放出的热量,
故答案为:等于;
(3)由盖斯定律可知,要得到金刚石转化为石墨的热量变化,可将二者在氧气中完全燃烧时放出的热量相减即可,
得C(金刚石,s)═C(石墨,s)△H=-Q1J/mol-(-Q2kJ/mol)=-(Q1-Q2)kJ/mol,即金刚石转化为石墨放出热量,放出的热量为Q1-Q2;
故答案为:放热;Q1-Q2.
本题解析:
本题难度:一般
2、填空题 (16分)Ⅰ.已知:
4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石) △H=-1080.9kJ/mol
4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol
试写出固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式 。
Ⅱ.硝基苯甲酸乙酯在OH— 存在下发生水解反应:O2NC6H4COOC2H5+OH-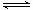 O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示:
t/s
| 0
| 120
| 180
| 240
| 330
| 530
| 600
| 700
| 800
|
α/%
| 0
| 33
| 42
| 49
| 59
| 73
| 74
| 75
| 75
|
回答下列问题:
(1)该反应在330~530s的平均反应速率为 (只列出算式,不做运算)。
(2)试计算某温度下该反应的平衡常数(写出计算过程)。
(3)为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 ,(写2条)。
Ⅲ.(1)下图装置中,开始电解时,Al电极反应式为 ,石墨电极反应式为 。
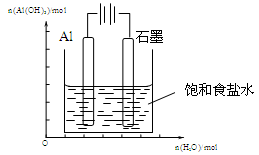
(2)通电一段时间后测得有0.6mol电子转移,作出Al(OH)3物质的量与消耗H2O的物质的量的的图象(反应物足量,作出标注)。
参考答案:Ⅰ.3Na2O(s)+C(s,金刚石) =4Na(g)+Na2CO3(l) △H= —4.2kJ/mol
或6Na2O(s)+2C(s,金刚石) =8Na(g)+2Na2CO3(l) △H= —8.4kJ/mol
(2分,方程式1分,△H的表示1分,状态错误0分;“—”、焓变数值、单位错漏合扣1分)
Ⅱ.
(1) (2分,结果写单位也可,单位错漏扣1分, 计算出结果:3.5×10-5mol/(L.s)也给分,合理即给分)
(2分,结果写单位也可,单位错漏扣1分, 计算出结果:3.5×10-5mol/(L.s)也给分,合理即给分)
(2) O2NC6H4COOC2H5 + OH- 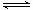 O2NC6H4COO- + C2H5OH
O2NC6H4COO- + C2H5OH
起始浓度(mol/L) 0.050 0.050 0 0
变化浓度(mol/L) 0.050 ×75% 0.050 ×75% 0.050 ×75% 0.050 ×75%
平衡浓度(mol/L) 0.050(1-75%) 0.050(1-75%) 0.050 ×75% 0.050 ×75% (1分)
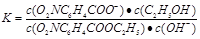 (1分)
(1分) 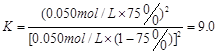 (2分)
(2分)
(共4分,其中:三段式1分,K的表达式1分,代入数值1分,计算结果1分。单位错漏扣1分,全部不带单位不扣分,有效数字错误不扣分,其他合理解法也给分)
(3)升高温度,增大OH-的浓度,移去产物(任答2条,共2分,合理即给分)
Ⅲ.(1)Al-3e-=Al3+或2Al-6e-=2Al3+(2分)
2H2O+2e-=2OH-+H2 ↑或6H2O+6e-=6OH-+3H2 ↑
或 2H++2e-=H2 ↑或 6H++6e-=3H2 ↑(2分)
(2)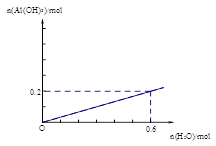 (2分,其中,曲线1分,标注1分)
(2分,其中,曲线1分,标注1分)
本题解析:Ⅰ 由盖斯定律可知:固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式:3Na2O(s)+C(s,金刚石) =4Na(g)+Na2CO3(l) △H= -3/2×(-357.5kJ/mol)+1/2(-1080.9kJ/mol)= —4.2kJ/mol;Ⅱ、(1)根据速率公式: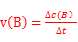 ,该反应在330~530s的平均反应速率为
,该反应在330~530s的平均反应速率为 mol/(L.s);(2)试计算某温度下该反应的平衡常数,由题意可知: O2NC6H4COOC2H5 + OH-
mol/(L.s);(2)试计算某温度下该反应的平衡常数,由题意可知: O2NC6H4COOC2H5 + OH- 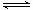 O2NC6H4COO- + C2H5OH
O2NC6H4COO- + C2H5OH
起始浓度(mol/L) 0.050 0.050 0 0
变化浓度(mol/L) 0.050 ×75% 0.050 ×75% 0.050 ×75% 0.050 ×75%
平衡浓度(mol/L) 0.050(1-75%) 0.050(1-75%) 0.050 ×75% 0.050 ×75%
则K=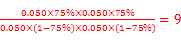 ;(3)为提高O2NC6H4COOC2H5的转化率,即应是平衡正向移动,O2NC6H4COOC2H5+OH-
;(3)为提高O2NC6H4COOC2H5的转化率,即应是平衡正向移动,O2NC6H4COOC2H5+OH-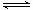 O2NC6H4COO-+C2H5OH为水解反应是吸热反应,故升高温度平衡正向移动,或增大OH-浓度使平衡正向移动增大O2NC6H4COOC2H5的转化率,或分离出乙醇等产物也能使平衡正向移动,故应采取条件为:升高温度或增大OH-浓度或分离出一部分产物;Ⅲ.(1)图装置中,Al电极为阳极,故该电极为Al放电,发生电极反应为2Al-6e-=2Al3+,阴极为水中H+放电,故电极反应为:6H++6e-=3H2 ↑或6H2O+6e-=6OH-+3H2 ↑;(2)通电一段时间后测得有0.6mol电子转移,则消耗水为0.6mol,产生Al(OH)3为0.2mol,故图象为:
O2NC6H4COO-+C2H5OH为水解反应是吸热反应,故升高温度平衡正向移动,或增大OH-浓度使平衡正向移动增大O2NC6H4COOC2H5的转化率,或分离出乙醇等产物也能使平衡正向移动,故应采取条件为:升高温度或增大OH-浓度或分离出一部分产物;Ⅲ.(1)图装置中,Al电极为阳极,故该电极为Al放电,发生电极反应为2Al-6e-=2Al3+,阴极为水中H+放电,故电极反应为:6H++6e-=3H2 ↑或6H2O+6e-=6OH-+3H2 ↑;(2)通电一段时间后测得有0.6mol电子转移,则消耗水为0.6mol,产生Al(OH)3为0.2mol,故图象为: 。
。
考点:化学反应原理综合。
本题难度:困难
3、选择题 下列有关热化学方程式及其叙述正确的是
[? ]
A.氢气的燃烧热为285.5 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) △H=+285.5kJ/mol
B.1mol甲烷完全燃烧生成CO2和H2O(l)时放出890 kJ热量,它的热化学方程式为:1/2CH4(g)+O2(g)=
1/2CO2(g)+H2O(l) △H=-445kJ/mol
C.已知2C(s)+O2(g)=2CO(g) △H= -221 kJ/mol,则C(碳)的燃烧热为110.5 kJ/mol
D.HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol
参考答案:B
本题解析:
本题难度:简单
4、填空题 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) 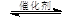 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2) / n(CO2)]
| 500 K
| 600 K
| 700 K
| 800 K
|
1.5
| 45%
| 33%
| 20%
| 12%
|
2.0
| 60%
| 43%
| 28%
| 15%
|
3.0
| 83%
| 62%
| 37%
| 22%
|
①若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比[n(H2) / n(CO2)],则K将 。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
。若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 g。
参考答案:(12分)(1)CH4(g) +2NO2(g)=N2(g) +CO2(g) +2H2O(g) △H=-867 kJ·mol-1(3分)
(2)①减小(2分) 不变(2分) ②CH3OCH3 -12e- +16OH-=2CO32- +11H2O(3分) ③9.6(2分)
本题解析:(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的。则两式相加,可得反应2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g),所以反应热△H=-574 kJ/mol--1160 kJ/mol=-1734 kJ/mol 。
(2)①根据表中数据可知,随着温度的升高,CO2的转化率是减小的,这说明升高温度平衡向逆反应方向移动,所以正方应是放热反应。升高温度平衡常数减小。温度不变,提高投料比[n(H2) / n(CO2)],CO2的转化率增大。但平衡常数只与温度有关系,因此平衡常数是不变的。
②原电池中负极失去电子,所以甲醚在负极通入。由于电解质是碱性的,则负极的电极反应式是CH3OCH3 -12e- +16OH-=2CO32- +11H2O。通电30s后成反应的甲醚是1.12 L·min-1×0.5min=0.56L,物质的量是0.56L÷22.4L/mol=0.025mol,因此根据电极反应式可知转移电子的物质的量是0.025mol×12=0.3mol。阴极是铜离子得到电子,电极反应式是Cu2++2e-=Cu,所以生成的铜是0.3mol÷2=0.15mol,质量是0.15mol×64g/mol=9.6g。
考点:考查盖斯定律的应用、外界条件对平衡状态以及平衡常数的影响、电化学原理的应用和计算
点评:该题是中等难度的试题,也是高考中的常见题型。试题贴近高考,难易适中,基础性强,有利于调动学生的学习兴趣和学习积极性,提高学生的应试能力和学习效率。也有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:困难
5、选择题 已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2( g ) + 3H2( g ) = 2NH3( g ) ΔH="—92.4" KJ/mol,则N≡N键的键能是
A.431 KJ/mol
B.946 KJ/mol
C.649 KJ/mol
D.869 KJ/mol