| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《化学平衡》考点巩固(2019年最新版)(十)
参考答案:D 本题解析:A.由题目可知反应为放热反应,加热,平衡逆向移动,CrO2Cl2的百分含量减小,故A错误。B.使用催化剂加快化学反应速率,但平衡不移动,CrO2Cl2的百分含量不变,故B错误。C.由题目可知反应为气体分子数目减小的反应,加压反应速率增大,平衡正向移动,CrO2Cl2的百分含量增大,故C错误。D. 分离出水气会使化学反应速率减小。故D正确。 本题难度:一般 2、选择题 已知可逆反应: |
参考答案:B
本题解析:略
本题难度:一般
3、简答题 反应①Fe(s)+CO2(g)?FeO(s)+CO(g)+akJ;
反应②CO(g)+
| 1 2 |
| 温度/℃ | 500 | 700 | 900 K 1.00 1.47 2.40 |
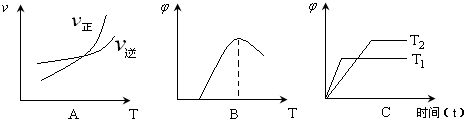
参考答案:(1)反应Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数k=c(CO)c(CO2);由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0,
平衡时参加反应的二氧化碳的物质的量为4mol×50%=2mol,则:
? Fe(s)+CO2(g)═FeO(s)+CO(g)
开始(mol):4? 0
变化(mol):2? 2
平衡(mol):2? ?2
平衡后一氧化碳浓度c(CO)=2mol2L=1mol/L;
故答案为:c(CO)c(CO2);大于;1mol/L;
(2)A.该反应前后气体的物质的量不变,缩小反应器体积,压强增大,平衡不移动,故A不符合;
B.通入CO2 ,浓度增大,平衡向正反应移动,故B符合;
C.该反应正反应是吸热反应,升高温度到900℃,平衡向正反应移动,故C符合;
D.使用合适的催化剂,加快反应速率,平衡不移动;
故答案为:BC;
(3)A、由图可知,升高温度,平衡向正反应移动,故图象表示正反应吸热反应,反应①正反应是吸热反应,图象与实际相符合,故A正确;
B、由图可知,最高点到达平衡,温度升高,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应①正反应是吸热反应,图象与实际不相符,故B错误;
C、由图可知,温度T1先到达平衡,故温度T1>T2,温度T1到达平衡时,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应①正反应是吸热反应,图象与实际不相符,故C错误;
故答案为:A;
(4)已知:①Fe(s)+CO2(g)═FeO(s)+CO(g)△H1=a?kJ?mol-1,
反应②CO(g)+1/2O2(g)═CO2(g)△H2=b?kJ?mol-1
由盖斯定律,2(①+②)得2Fe(s)+O2(g)═2FeO(s),故△H3=2(a?kJ?mol-1+b?kJ?mol-1)=2(a+b)kJ?mol-1,
故答案为:2(a+b)kJ?mol-1;
本题解析:
本题难度:一般
4、选择题 在一定条件下,可逆反应X(g)+2Y(g) 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
A.2:1
B.1:1
C.2:3
D.3:2
参考答案:B
本题解析:假设起始的X和Y分别为x、ymol,反应X为amol,Y为2amol;有a/x=25%;2a/y=50%;故x:y=1:1。
本题难度:简单
5、选择题 下列事实能用勒夏特列原理来解释的是
A.实验室采用排饱和食盐水的方法收集Cl2
B.500℃左右的温度比室温更有利于合成氨反应
C.H2、I2、HI平衡混合气体加压后颜色加深
D.SO2氧化为SO3,往往需要使用催化剂
参考答案:A
本题解析:勒夏特列原理又称为平衡移动原理,A、实验室采用排饱和食盐水的方法收集Cl2,深夜中氯离子抑制了氯气的溶解,使平衡Cl2+H2O H++Cl-+HClO向逆方向移动,A符合;B、合成氨的反应是放热反应,从化学平衡移动的角度,低温更有利于合成氨反应,B不符合;C、该反应是体积不变的反应,加压平衡不移动,C不符合;D、使用催化剂,不影响化学平衡的移动,D不符合;答案选A。
H++Cl-+HClO向逆方向移动,A符合;B、合成氨的反应是放热反应,从化学平衡移动的角度,低温更有利于合成氨反应,B不符合;C、该反应是体积不变的反应,加压平衡不移动,C不符合;D、使用催化剂,不影响化学平衡的移动,D不符合;答案选A。
考点:勒夏特列原理
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《有机化合物.. | |