| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《化学平衡》考点巩固(2019年最新版)(八)
参考答案:(1)①增大 本题解析:(1)①因为炼铁反应为吸热反应,升高温度,平衡常数增大。 本题难度:一般 3、选择题 有些物质的制备从化学性质的“强制弱”来看似乎难以进行,但利用勒夏特列原理却取得了成功,以下属于这种情况的是 |
参考答案:AB
本题解析:A.物质的酸性HBr> H3PO4,所以从化学性质的“强制弱”来看NaBr(s)+H3PO4(浓) NaH2PO4(aq)+ HBr(g)难以进行,但是由于HBr容易挥发,而H3PO4是高沸点难挥发的酸,当HBr脱离平衡体系后,减小生成物的浓度平衡正向移动,H3PO4逐渐转化为HBr,正确;B.元素的金属性Ca>Al,所以从活动性强的制取活动性弱的来看,6CaO(l)+2Al(l)
NaH2PO4(aq)+ HBr(g)难以进行,但是由于HBr容易挥发,而H3PO4是高沸点难挥发的酸,当HBr脱离平衡体系后,减小生成物的浓度平衡正向移动,H3PO4逐渐转化为HBr,正确;B.元素的金属性Ca>Al,所以从活动性强的制取活动性弱的来看,6CaO(l)+2Al(l) 3CaO?Al2O3(s) +3Ca(g)不能进行,但是由于Ca的沸点低,Al的沸点高,当产生的Ca变为蒸汽从平衡体系中脱离后,更多的Al发生反应制取得到了Ca,正确;C.由于酸性HCl>H2CO3,所以CaCO3(s) +2HCl(aq) =CaCl2(aq) +H2O (l) +CO2(g) 从化学性质的“强制弱”来看可以发生,错误;D.由于还原性: H2S >IH,所以反应KICl2(aq)+H2S(aq)=KI (aq)+2HCl (aq) +S(s)可以发生,错误。
3CaO?Al2O3(s) +3Ca(g)不能进行,但是由于Ca的沸点低,Al的沸点高,当产生的Ca变为蒸汽从平衡体系中脱离后,更多的Al发生反应制取得到了Ca,正确;C.由于酸性HCl>H2CO3,所以CaCO3(s) +2HCl(aq) =CaCl2(aq) +H2O (l) +CO2(g) 从化学性质的“强制弱”来看可以发生,错误;D.由于还原性: H2S >IH,所以反应KICl2(aq)+H2S(aq)=KI (aq)+2HCl (aq) +S(s)可以发生,错误。
考点:考查勒夏特列原理在物质制取中的应用的知识。
本题难度:一般
4、填空题 研究NO2、SO2、CO等大气污染物的处理具有重要意义。NO2可用下列反应来处理:
6 NO2(g)+8NH3(g) 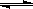 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
完成下列填空:
(1)反应的平衡常数大,处理NO2的效率高。增大该反应平衡常数的措施有?。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是?。
a.c(NO2):c(NH3) = 3:4? b.6v(NO2) = 7v(N2)
c.容器内气体总压强不再变化? d.容器内气体密度不再变化
(3)若平衡时NO2和N2的浓度之比为m/n,保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比 ?m/n(填“>”、“=”或“<”)。
(4)某温度下,在一个容积为2升的反应容器内,上述反应2分钟后达到平衡,测得刚好有3mol电子发生转移,则在2分钟内NH3的平均反应速率为:
v(NH3) = ?。
参考答案:(1)降低温度(2分)?
(2)c(2分)?
(3)> (2分)?
(4)0.25 mol/(L·min) (1分×2)
本题解析:(1)只与温度有关,该反应正反应是放热反应,要增大该反应平衡常数的措施有降低温度。
(2)该反应前后体积发生了变化,所以容器内气体总压强不再变化应做为平衡判断的标志。
(3)保持其它条件不变,缩小反应容器的体积相当于增大了压强,平衡向逆向移动,所以平衡时NO2和N2的浓度之比为m/n大于之前的。
(4)当转移24mol电子时NH3反应了8mol,3mol电子发生转移NH3反应了1mol,根据速率计算公式则在2分钟内NH3的平均反应速率为:v(NH3) =" 1/2*2=0.25" mol/(L·min)
本题难度:一般
5、填空题 (10分) 在一密闭容器中加入A、B进行可逆反应:A(g) + B(g) mC(g), A的转化率(αA)与温度(T)、压强的关系如下图所示:
mC(g), A的转化率(αA)与温度(T)、压强的关系如下图所示: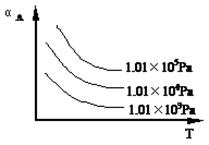
(1)此反应的正反应是 (放热、吸热)反应
(2)若保持其它条件不变,升高温度,C的产率将 (变大、变小);
(3)正反应是体积 (缩小、增大)的反应,m值为 ;
(4)若要提高A的转化率,可采取的措施是: (只写两个)。
参考答案:(1)放热;(2)变小;(3)缩小,1 ;(4)①加压,②降温,③加入反应物,④分离出产物C
本题解析:(1)根据图像可知:在其它条件不变时,升高温度,A的转化率降低,说明升高温度,平衡逆向移动。根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应;(2)若保持其它条件不变,由于该反应的正反应是放热反应,所以升高温度,平衡逆向移动,所以C的产率将变小;(3)在温度不变时,增大压强,A的转化率增大;说明增大压强,平衡正向移动,根据平衡移动原理:增大压强,平衡向气体体积减小的方向移动,该反应的正反应是气体体积减小的反应;(4)若要提高A的转化率,即使平衡正向移动,由于该反应的正反应是氢氧体积减小的放热反应,所以根据平衡移动原理,可采取的措施是降低温度、增大压强或加入反应物、从体系中分离出生成物的方法。
考点:考查图像法在确定反应的方程式、物质的转化率、平衡移动等影响的知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《有机化合物.. | |