|
|
|
高中化学知识点总结《化学平衡》考点巩固(2019年最新版)(七)
2020-07-08 01:32:56
【 大 中 小】
|
1、填空题 (6分)在利用镁条与醋酸的反应研究化学反应速率的影响因素的实验中,同学们记录了相同体积、不同浓度的醋酸与足量Mg条反应,产生H2体积随时间变化的数据,并以单位时间内产生H2的体积来表示反应速率,其反应速率随时间变化的图(如图所示)。
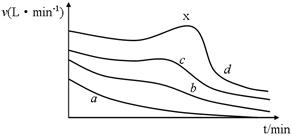
(1)在a、b、c、d四条曲线中,对应醋酸溶液的物质的量浓度最小的是_________,反应最后产生的H2在相同条件下体积最大的是_____________。
(2)在d曲线中,反应一段时间以后,反应速率出现反常的升高的现象(x点附近)。产生这种现象的原因主要是____________。
2、填空题 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g)? ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。 Fe(s)+CO2(g)? ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值?(填“增大”、“减小”或“不变”);
②1 100 ℃时测得高炉中,c(CO2)="0.025" mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向?进行(填“左”或“右”),判断依据是?。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)? ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。 CH3OH(g)+H2O(g)? ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
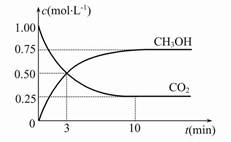
①从反应开始到平衡,氢气的平均反应速率v(H2)=?。
②反应达到平衡后,下列措施能使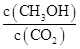 增大的是?(填符号)。 增大的是?(填符号)。
A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
| E.充入He(g)
3、选择题 有些物质的制备从化学性质的“强制弱”来看似乎难以进行,但利用勒夏特列原理却取得了成功,以下属于这种情况的是
A.NaBr(s)+H3PO4(浓) NaH2PO4(aq)+ HBr(g) NaH2PO4(aq)+ HBr(g)
B.6CaO(l)+2Al(l)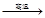 3CaO?Al2O3(s) +3Ca(g) 3CaO?Al2O3(s) +3Ca(g)
C.CaCO3(s) +2HCl(aq) →CaCl2(aq) +H2O (l) +CO2(g)
D.KICl2(aq)+H2S(aq)→KI (aq)+2HCl (aq) +S(s)
|
4、填空题 研究NO2、SO2、CO等大气污染物的处理具有重要意义。NO2可用下列反应来处理:
6 NO2(g)+8NH3(g) 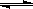 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
完成下列填空:
(1)反应的平衡常数大,处理NO2的效率高。增大该反应平衡常数的措施有?。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是?。
a.c(NO2):c(NH3) = 3:4? b.6v(NO2) = 7v(N2)
c.容器内气体总压强不再变化? d.容器内气体密度不再变化
(3)若平衡时NO2和N2的浓度之比为m/n,保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比 ?m/n(填“>”、“=”或“<”)。
(4)某温度下,在一个容积为2升的反应容器内,上述反应2分钟后达到平衡,测得刚好有3mol电子发生转移,则在2分钟内NH3的平均反应速率为:
v(NH3) = ?。
5、填空题 (10分) 在一密闭容器中加入A、B进行可逆反应:A(g) + B(g) mC(g), A的转化率(αA)与温度(T)、压强的关系如下图所示:
mC(g), A的转化率(αA)与温度(T)、压强的关系如下图所示:
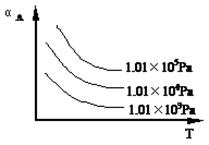
(1)此反应的正反应是 (放热、吸热)反应
(2)若保持其它条件不变,升高温度,C的产率将 (变大、变小);
(3)正反应是体积 (缩小、增大)的反应,m值为 ;
(4)若要提高A的转化率,可采取的措施是: (只写两个)。
 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。 mC(g), A的转化率(αA)与温度(T)、压强的关系如下图所示:
mC(g), A的转化率(αA)与温度(T)、压强的关系如下图所示: