|
|
|
高中化学知识点总结《化学平衡》考点巩固(2019年最新版)(九)
2020-07-08 01:32:56
【 大 中 小】
|
1、选择题 在523K时,有以下反应:2HCl(g)+ CrO3(g) CrO2Cl2(g)+H2O(g) +Q (Q>0),反应进行至第5min时,改变某个条件,当反应进行至第10 min时,发现生成CrO2Cl2(g)的速率增大,CrO2Cl2的百分含量也增大,则改变的条件不可能是 CrO2Cl2(g)+H2O(g) +Q (Q>0),反应进行至第5min时,改变某个条件,当反应进行至第10 min时,发现生成CrO2Cl2(g)的速率增大,CrO2Cl2的百分含量也增大,则改变的条件不可能是
A.加热
B.使用催化剂
C.加压
D.分离出水气
|
2、选择题 已知可逆反应: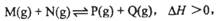 在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)="2.4" mol·L-1;达到平衡后,M的转化率为60%,若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1, 在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)="2.4" mol·L-1;达到平衡后,M的转化率为60%,若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,
c(N)=" a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a为 ( )
A.5
B.6
C.7
D.8
|
3、简答题 反应①Fe(s)+CO2(g)?FeO(s)+CO(g)+akJ;
反应②CO(g)+
O2(g)?CO2(g)+bkJ.
测得在不同温度下,反应①的平衡常数K值随温度的变化如表所示:
| 温度/℃ | 500 | 700 | 900
K
1.00
1.47
2.40
|
(1)反应①的化学平衡常数表达式为______,a______0(填“大于”、“小于”或“等于”).?在500℃2L密闭容器中进行反应①,CO2起始量为4mol,其转化率为50%,则CO的平衡浓度为______.
(2)700℃反应①达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有______(填序号).
A.缩小反应器体积?B.通入CO2 C.升高温度到900℃D.使用合适的催化剂
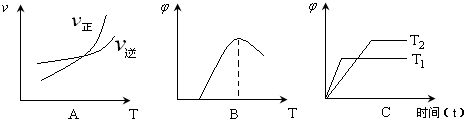
(3)图象符合反应①的是______(填序号)(图中v是速率、φ为混合物中CO含量,T为温度且T1>T2).
(4)由反应①和②可求得,反应2Fe(s)+O2(g)?2FeO(s)+Q?的Q=______.
4、选择题 在一定条件下,可逆反应X(g)+2Y(g) 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
A.2:1
B.1:1
C.2:3
D.3:2
5、选择题 下列事实能用勒夏特列原理来解释的是
A.实验室采用排饱和食盐水的方法收集Cl2
B.500℃左右的温度比室温更有利于合成氨反应
C.H2、I2、HI平衡混合气体加压后颜色加深
D.SO2氧化为SO3,往往需要使用催化剂

 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为