1、选择题 已知450 ℃时,反应H2(g)+I2(g) 2HI(g)的K=50,由此推测在450 ℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450 ℃时,反应2HI(g) H2(g)+
H2(g)+
I2(g)的化学平衡常数为
[? ]
A.50
B.0.02
C.100
D.无法确定
参考答案:B
本题解析:
本题难度:一般
2、填空题 温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2反应生成CH3OH.
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)
(1)500℃时,在体积为1L的容积固定的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
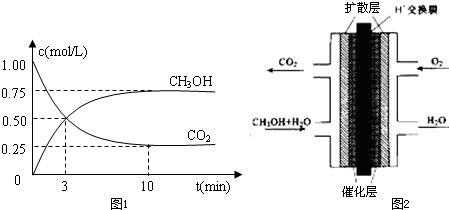
①从反应开始到平衡,氢气的平均反应速率v(H2)=______mol?L-1?min-1.
②该反应的平衡常数K=______(保留一位小数),平衡时H2的转化率为______.
③已知温度升高,K值减小.下列措施中能使增大的是______.
A.升高温度B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离D.再充入1molCO2和3molH2
(2)CH3OH作为内燃机燃料或通过燃料电池驱动车辆.可减少CO2排放多达45%.
①已知:
CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1=+49.0kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则反应CH3OH(g)+O2(g)═CO2(g)+2H2(g)的△H=______kJ?mol-1.
②甲醇质子交换膜燃料电池的结构示意图如图2,已知H+移向通入O2的电极,甲醇进入______极(填“正”或“负”),正极发生的电极反应为______.
参考答案:(1)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,故v(CH3OH)=0.75mol/L10min=0.075mol/(L.min),速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=0.075mol/(L.min)×3=0.225mol/(L.mon),
故答案为:0.225;
②CO2(g)+3H2(g)一定条件
本题解析:
本题难度:一般
3、选择题 某温度下,在固定容积的容器中,可逆反应:A(g)+3B(g)?2C(g)达到平衡,测得平衡时物质的量之比为2:2:1,保持温度、体积不变,再以2:2:1的体积比将A、B、C充入此容器中,则( )
A.平衡向逆反应方向移动
B.平衡不移动
C.C的百分含量增大
D.B的浓度减小
参考答案:可逆反应:A(g)+3B(g)?2C(g),再以2:2:1的体积比将A、B、C充入此容器中,各物质的浓度增大一倍,相当于在原来的基础上压缩体积为原来的一半,压强增大,则
A.增大压强平衡向正反应方向移动,故A错误;
B.由于反应前后气体的化学计量数之和不等,则增大压强平衡发生移动,故B错误;
C.平衡向正反应方向移动,C的百分含量增大,故C正确;
D.浓度增大,平衡向正反应方向移动,由勒沙特列原理可知,平衡移动减弱影响的趋势但不能改变浓度增大的趋势,B的浓度增大,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 下图是温度和压强对反应X + Y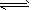 2Z影响的示意图。 下列叙述正确的是
2Z影响的示意图。 下列叙述正确的是
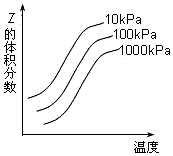
[? ]
A.该反应为放热反应
B.增大压强,平衡正向移动
C.X、Y、Z均为气态
D.X和Y中只有一种为气态,Z为气态
参考答案:D
本题解析:
本题难度:一般
5、选择题 如图是温度和压强对X+Y2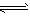 Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
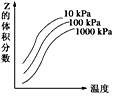
[? ]
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气体
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应ΔH>0
参考答案:C
本题解析:
本题难度:一般