1、填空题 t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3 A(g)+B(g)  ?xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:
?xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为?;
(2)x=_______;
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) (?)
A.向正反应方向移动? B.向逆反应方向移动? C.不移动
(4)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=??mol;
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为?。
参考答案:(9分)(1) 0.2mol/L.min? (2) 4
(3) c? (4) 0.8+0.2a
(5) n(A)=3n(B),n(C)>0或n(A)+(3/4)n(c)="3n(B)+(1/4)n(c)" (无n(C)>0不扣分)
(第一空1分,其余每空2分)
本题解析:(1)2min达平衡时,容器中剩余0.8molB,则消耗0.2molB,c(C)=0.4mol?L-1,v(C)="0.4(mol/L)/2(min)" =0.2mol?L-1?min-1,
(2)v(B)=(0.2mol/2L)/2min=0.05mol?L-1?min-1,由化学反应速率之比等于化学计量数之比,则v(B)/v(C)=1/x,解得x=4,故答案为:0.2mol/Lmin;4;
(4)向原平衡混合物的容器中再充入amolC,在T℃达到新的平衡与原平衡等效,
3A(g)+B(g) 4C(g),
4C(g),
开始3 ?1 ?0
转化 0.6?0.2 ?0.8
平衡 2.4 ?0.8 ?0.8
此时B的含量为[0.8mol/(2.4mol+0.8mol+0.8mol)]×100%=20%,
设有4xmolC转化为B,达平衡时n(B)=(0.8+x)mol,则有[(0.8+x)mol/(4+a)mol]×100%=20%,
解得x=0.2amol,即再充入amolC,在T℃达到新的平衡,此时B的物质的量为n(B)为(0.8+0.2a)mol,
故答案为:(0.8+0.2a)mol。
点评:本题较难,考查化学反应速率及化学平衡,学生能利用等效平衡来分析(5)是解答本题的关键。
本题难度:困难
2、选择题 一带有活塞的绝热密闭容器中盛有A、B组成的混合气体,并发生如下反应:
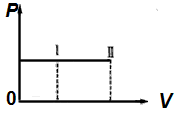
A(g)+ B(g) 2C(g),在通常条件下,反应从状态Ⅰ变化到状态Ⅱ时,气体体积(V)与气体压强(P)的变化曲线如图所示。则下列说法正确的是
2C(g),在通常条件下,反应从状态Ⅰ变化到状态Ⅱ时,气体体积(V)与气体压强(P)的变化曲线如图所示。则下列说法正确的是
[? ]
A.反应物具有的总能量等于生成物具有的总能量
B.反应从状态Ⅰ变化到状态Ⅱ时,混合气体的平均相对分子质量减小
C.反应从状态Ⅰ变化到状态Ⅱ时,反应速率一定减小
D.该反应是放热反应
参考答案:D
本题解析:
本题难度:一般
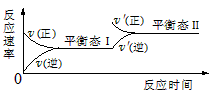
3、选择题 如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是
[? ]
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.同一种反应物在平衡态I和平衡态II时浓度不相等
参考答案:C
本题解析:
本题难度:一般
4、填空题 (16分)氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)NaH是一种生氢剂,NaH与H2O反应放出H2.NaH含有的化学键为________(填“离子键”或“共价键”),NaH与H2O反应的化学方程式为________________.
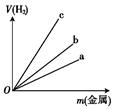
(2)写出实验室用锌与稀硫酸反应制取H2的离子方程式:_________.图中三根曲线表示锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系,其中能表示铝的是________(填“a”“b”或“c”).
(3)金属-有机框架物(MOFs)储氢材料是由金属氧化物团簇通过有机高分子链组装形成的晶态材料.MOFs储氢材料比表面积大,空隙率高,储氢容量大,其储氢和放氢的原理可表示为MOFs(s)+nH2(g)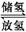 (H2)nMOFs(s),ΔH<0,则储氢时的适宜条件为________(填字母).
(H2)nMOFs(s),ΔH<0,则储氢时的适宜条件为________(填字母).
A.低温低压
B.低温高压
C.高温低压
D.高温高压
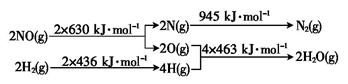
 CH4(g) + 2H2O(g)
CH4(g) + 2H2O(g)