1、选择题 氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25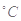 时:
时:

在20Ml0.lmol/L的氢氟酸中滴加0.lmol/L的NaOH V mL,下列说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:
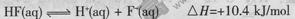
B.当V="20" mL时,溶液中: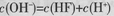
C.当V="20" mL时,溶液中: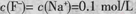
D.当v>0时,溶液中一定存在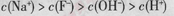
参考答案:B
本题解析:A.利用盖斯定律将①-②可得HF(aq)?F-(aq)+H+(aq)△H=-10.4?kJ?mol-1,故A错误;B.当V=20时,恰好反应生成NaF,溶液呈碱性,根据质子守恒可得c(OH-)=c(HF)+c(H+),故B正确;C.当V=20时,恰好反应生成NaF,应F-水解,则c(F-)<c(Na+)=0.05mol?L-1,故C错误;D.溶液离子浓度大小关系取决于V,V不同,浓度关系可能不同,溶液也可能呈酸性,故D错误;故选B。
本题难度:一般
2、选择题 下列说法正确的是( )
A.反应4Fe(OH)2(s)+O2(g)+2H2O(l)═4Fe(OH)3(s)的△H>0
B.电解精炼铜时,用粗铜作阳极、纯铜作阴极、CuSO4溶液作电解质溶液
C.25℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大
D.pH=5的CH3COOH溶液和pH=5的AlCl3溶液中,水的电离程度相同
参考答案:A、反应4Fe(OH)2(s)+O2(g)+2H2O(l)═4Fe(OH)3(s)的△H<0,故A错误;
B、电解精炼铜时,用粗铜作阳极、纯铜作阴极、CuSO4溶液作电解质溶液,符合电解精炼原理,故B正确;
C、氯化铵溶液水解显酸性,氢氧化镁溶解于氯化铵溶液中,25℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大,故C正确;
D、醋酸抑制水的电离,氯化铝水解促进水的电离;水的电离程度不相同,故D错误;
故选BC.
本题解析:
本题难度:简单
3、填空题 (I某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如下:

(1)1 mo1NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是? _?。
(2)在一定条件下,向废水中加入CH3OH,将HNO3还原成 N2,若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是_?。
(B)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术
将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO十2CO 2CO2+ N2?△H
2CO2+ N2?△H
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表:
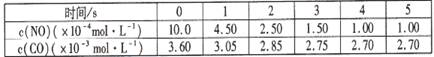
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H?0(填写“>”、“<”、“=”)
(2)在该温度下,反应的平衡常数K=?(只写出计算结果);
(3)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,
部分实验条件如下表:

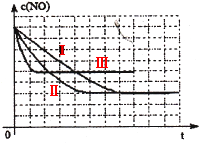
该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号; 
参考答案:(I)(1)NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)?
△H=-346kJ·mol-1
(2)5:6
(Ⅱ)(1)<
(2)5000
(3)见图
本题解析:(I)(1)NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)?
1 mo1NH4+(aq)全部氧化成NO3-(aq)的热化学方程式中△H为第一步反应和第二部反应之和即为:-346kJ·mol-1;(2)32gCH3OH的物质的量为1mol,转移电子6mol表示氧化剂HNO3得到6mol电子,由于HNO3中N元素有+5价将为N2中的0价因此需要1.2molHNO3参与反应。因此参加反应的还原剂CH3OH和氧化剂HNO3的物质的量之比是5:6。
(Ⅱ)(1)此反应为气体体积缩小的反应△S<0,由于反应能够自发进行因此△G=△H-T△S<0,因此
△H<0
(2)? 2NO?+?2CO? ?2CO2?+? N2
?2CO2?+? N2
始:10.0×10-4?3.6×10-3? 0? 0
变:9.00×10-4? 9.00×10-4? 9.00×10-4? 4.50×10-4
终:1.00×10-4? 2.7×10-3? 9.00×10-4? 4.50×10-4
由公式计算可得K=5000
(3)Ⅱ对比I增加了催化剂的比表面积,催化剂只会缩短达到平衡的时间并不影响平衡的移动;Ⅲ对比Ⅱ提高了反应的温度,平衡向吸热方向移动,即向逆反应方向移动c(NO)提高。
本题难度:困难
4、选择题 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)?+?OH-(aq)=?H2O(l)?△H=-57.3kJ/mol。向1L?0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸?②浓硫酸?③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是?
[? ]
A.△H1>△H2>△H3?
B.△H1<△H3<△H2
C.△H1<△H2<△H3
D.△H1>△H3>△H2
参考答案:D
本题解析:
本题难度:简单
5、填空题 (1)利用盖斯定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式:?。
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键
能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H=?kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=____________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈?(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) ?c(CH3COO-)(填“ >” 或“=” 或“<” )。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈?,溶液中c(Na+)
?c(CH3COO-) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈?,醋酸体积?氢氧化钠溶液体积。
参考答案:(1)2N2H4(g)+ 2NO2(g)= 3N2(g)+ 4H2O(g)?ΔH=" -1135.7" kJ·mol-1 (2分)
(2)-52kJ·mol-1(2分)
(3)① 0.05mo1·L-1 (1分) ②1×10-11mo1/L(2分) ③ 2(2分)
(4)(1)碱性,>;(2分)?(2)酸性,<;(2分)?(3)中性,>; (2分)
本题解析:(1)根据盖斯定律:①N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1
②N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
①×2-②:2N2H4(g)+ 2NO2(g)= 3N2(g)+ 4H2O(g)?ΔH=" -1135.7" kJ·mol-1。
(2) N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)的
NH3(g)的
△H= ×946kJ·mol-1+
×946kJ·mol-1+ ×436kJ·mol-1-3×393kJ·mol-1=-52kJ·mol-1。
×436kJ·mol-1-3×393kJ·mol-1=-52kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,c(H+)=10-13mol/L,c(OH-)=10-1mol/L,
①故Ba(OH)2溶液的物质的量浓度为0.05mol/L;
②加水稀释100倍,c(OH-)=10-3mol/L,这是Kw=c(OH-)·c(H+)水=10-14,溶液中由水电离出c(OH-)=c(H+)水=10-11mol/L。
③溶液pH=11,即c(OH-)=10-3mol/L,它与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合:
1×10-1 mol/L -9×c(H+)HCl=10×10-3mol/L,c(H+)HCl=0.01mol/L,故该盐酸溶液的pH=2。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后生成CH3COONa,其水解溶液呈碱性,溶液中c(Na+)>c(CH3COO-)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合,CH3COOH已电离的与NaOH发生反应,醋酸仍继续电离使溶液呈酸性,溶液中c(Na+)<c(CH3COO-) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,根据电荷守恒可以推出c(OH-)=c(H+),则混合后溶液呈中性,由①可知,醋酸体积大于氢氧化钠溶液体积。3COOH溶液后的酸碱性判断等。
本题难度:一般