1、选择题 下列说法正确的是
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.配制一定物质的量浓度的溶液,在移液时玻璃棒轻靠在容量瓶瓶口
D.SO2和HClO都具有漂白作用,且漂白的化学原理相同
参考答案:B
本题解析:
本题难度:一般
2、选择题 应用元素周期律和元素周期表,判断下列说法正确的是(?)
A.碱金属单质的熔点随原子序数的增大而降低
B.砹(At)是VIIA族元素,HAt的稳定性大于HCl
C.第2周期非金属的气态氢化物溶于水后所得溶液均为酸性
D.铊(TI)与铝同主族,其单质既能与盐酸反应又能与NaOH溶液反应
参考答案:A
本题解析:A.碱金属单质的熔点随原子序数的增大而降低,正确;B.砹(At)是VIIA族元素,HAt的稳定性小于HCl,错误;C.第2周期非金属的气态氢化物溶于水后所得溶液除氨水显碱性外其余的均为酸性,错误;D.铊(TI)与铝同主族,由于去金属性比Al强,所以其单质只能与盐酸反应而不能能与NaOH溶液反应,错误。
本题难度:一般
3、选择题 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
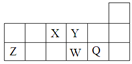
A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+)
B.元素W的最高价氧化物对应水化物的酸性比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
参考答案:B
本题解析:X、Y、Z、W、Q分别为N、O、Al、S、Cl。A、电子层数多半径大,电子层数同,质子数多半径小,正确;B、非金属性S<Cl,所以元素W的最高价氧化物对应水化物的酸性比Q的弱,错误;C、元素X的氢化物与Q的氢化物化合的产物为NH4Cl,既含共价键又含离子键,正确;D、X、W、Q三种元素的最高价氧化物对应水化物为酸,Z对应的为两性氢氧化物均能与强碱反应,正确。
本题难度:一般
4、推断题 X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素
| 相关信息
|
X
| X的基态原子L层电子数是K层电子数的2倍
|
Y
| Y的基态原子最外层电子排布式为:nsnnpn+2
|
Z
| Z存在质量数为23,中子数为12的核素
|
W
| W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色
|
(1)X的电负性比Y的______(填“大”或“小”);
(2)写出W的价电子排布式?写出Z2Y2与XY2反应的化学方程式,?当1摩尔Z2Y2参加反应时,转移电子的数目:______________。
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:______________。
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是?(写化学式)
参考答案:(12分) (1) 小? (2) 3d64s2? 2Na2O2 + 2CO2 ==2Na2CO3 + O2? NA(或6.02×1023)
(3)? CO2 +CO32- + H2O=2HCO3-? (4)SiH4
本题解析:X的基态原子L层电子数是K层电子数的2倍,则X是碳元素。Y的基态原子最外层电子排布式为:nsnnpn+2,则n=2,所以Y是氧元素。Z存在质量数为23,中子数为12的核素,则质子数是11,是钠元素。W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则W是Fe元素。
(1)非金属性越强,电负性越大,则氧元素的电负性大于碳元素的。
(2)根据构造原理可知,铁元素的价电子排布式是3d64s2。过氧化钠能和CO2反应生成碳酸钠和氧气,反应的方程式是2Na2O2 + 2CO2 ==2Na2CO3 + O2,其中过氧化钠既是氧化剂,也是还原剂,1mol过氧化钠转移1mol电子,所以当1摩尔Z2Y2参加反应时,转移电子的数目NA(或6.02×1023)。
(3)CO2能和碳酸盐生成碳酸氢盐,反应的离子方程式是CO2 +CO32- +H2O=2HCO3-。
(4)甲烷和SiH4的结构相似,形成的晶体类型是分子晶体,甲烷的相对分子质量小,所以沸点低于SiH4的。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
5、选择题 下列说法正确的是( )。
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D. 的核外电子数目为18,则X在第四周期第ⅡA族
的核外电子数目为18,则X在第四周期第ⅡA族
参考答案:D
本题解析:最活泼的金属在周期表的左下方,为Fr,最活泼的非金属是F,A错;Mg(OH)2碱性比Ca(OH)2弱,B错;元素周期表共有18个纵行,C错;D中X是钙元素,D正确。
本题难度:一般