1、选择题 下列说法正确的是
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.配制一定物质的量浓度的溶液,在移液时玻璃棒轻靠在容量瓶瓶口
D.SO2和HClO都具有漂白作用,且漂白的化学原理相同
2、选择题 应用元素周期律和元素周期表,判断下列说法正确的是(?)
A.碱金属单质的熔点随原子序数的增大而降低
B.砹(At)是VIIA族元素,HAt的稳定性大于HCl
C.第2周期非金属的气态氢化物溶于水后所得溶液均为酸性
D.铊(TI)与铝同主族,其单质既能与盐酸反应又能与NaOH溶液反应
3、选择题 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
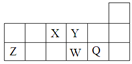
A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+)
B.元素W的最高价氧化物对应水化物的酸性比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
4、推断题 X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素
| 相关信息
|
X
| X的基态原子L层电子数是K层电子数的2倍
|
Y
| Y的基态原子最外层电子排布式为:nsnnpn+2
|
Z
| Z存在质量数为23,中子数为12的核素
|
W
| W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色
|
(1)X的电负性比Y的______(填“大”或“小”);
(2)写出W的价电子排布式?写出Z2Y2与XY2反应的化学方程式,?当1摩尔Z2Y2参加反应时,转移电子的数目:______________。
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:______________。
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是?(写化学式)
5、选择题 下列说法正确的是( )。
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D. 的核外电子数目为18,则X在第四周期第ⅡA族
的核外电子数目为18,则X在第四周期第ⅡA族